题目内容
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是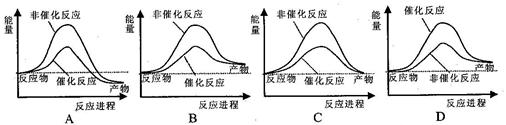
B
解析试题分析:A、水的分解为吸热反应,反应物的总能量小于生成物的总能量,与图不符,故A错;B、加入催化剂反应热不变,并且图象符合反应物的总能量小于生成物的总能量,故B正确;C、化学反应一定伴随着能量变化,反应物的总能量与生成物的总能量不相等,故C错;D、加入催化剂降低反应的活化能,图象不符合,故D错,答案选B。
考点:考查外界条件对反应速率的影响以及图像识别

练习册系列答案
相关题目
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是( )
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
下列热化学方程式正确的是( 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H= +116.2kJ/mol(反应热) |
氢气虽然是一种理想的绿色能源,但目前仍处在研究、实验阶段,还未得到广泛应用,其原因可能是
| A.氢气虽可由水制备获得,但水资源严重匮乏 |
| B.氢气制备耗能巨大,廉价制氢技术尚未成熟 |
| C.氢气贮存、运输等安全技术已经很好地解决了 |
| D.氢气燃烧产物虽无污染,但其放出热量较少 |
下列有关能量转换的说法正确的是
| A.煤燃烧是化学能全部转化为热能的过程 |
| B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.盖斯定律,可计算某些难以直接测量的反应的焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
如图所示是101kPa时,氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )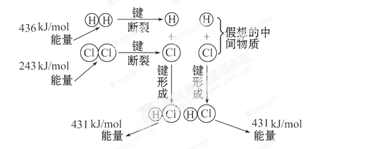
| A.此反应的热化学方程式为:H2(g)+Cl2(g) =2HCl(g) ΔH=+183kJ·mol-1 |
| B.2molHCl分子中的化学键形成时要释放862kJ能量 |
| C.1molH2中的化学键断裂时需要吸收436kJ能量 |
| D.此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g) =HCl(g) ΔH=-91.5kJ·mol-1 |
已知:N2(g)+3H2(g) 2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
| | H2(g) | N2(g) | NH3(g) |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
B.a的数值为391
C.Q1的数值为92
D.相同条件下,反应物若为2molN2和6molH2,放出热量Q2>2Q1
下列有关化学反应与能量的说法正确的是
| A.酸碱中和是放热反应 |
| B.炭在氧气中燃烧属于吸热反应 |
| C.化学键的形成需吸收能量 |
| D.化学反应过程中,化学能一定转化成热能 |