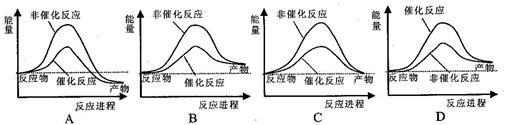
题目内容
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.盖斯定律,可计算某些难以直接测量的反应的焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
C
解析试题分析:A、生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,故A错误;B、反应速率与反应是吸热还是放热无关,反应速率与反应物本身的性质及外界条件有关,故B错误;C、反应的热效应只与始态、终态有关,与过程无关,根据盖斯定律可计算某些难以直接测量的反应焓变,故C正确;D、反应的热效应只与始态、终态有关,与过程无关,所以同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,故D错误,答案选C。
考点:考查反应热的有关判断

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
下列说法正确的是( )
| A.物质的化学变化都伴随着能量变化 |
| B.凡是吸热反应都需要加热 |
| C.任何反应中的能量变化都表现为热量变化 |
| D.拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |
已知1g氢气完全燃烧生成水蒸气时放出热量12lkJ。且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为
| A.920kJ | B.557kJ | C.436kJ | D.188kJ |
下列说法正确的是
| A.蓄电池充电时其负极应与外电源的的正极相连接 |
| B.同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的△H相同 |
C.已知:H2(g)+I2(g)  2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 |
| D.已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1 |
在一定条件下,A和B反应可生成C和D,其能量变化如下:
下列有关反应A+B=C+D的说法正确的是( )
| A.反应前后原子的种类和数目可能改变 |
| B.该反应若有热量变化,则一定是氧化还原反应 |
| C.若该反应为放热反应,则不需加热反应就一定能进行 |
| D.该反应遵循能量守恒,所以一定有能量变化 |
将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
| A.实验中玻璃棒的作用是加速固体溶解 |
| B.玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 |
| C.所取反应物质量的多少会影响反应是吸热,还是放热 |
| D.该反应中,反应物的总能量小于生成物的总能量 |
硫单质有两种常见的同素异形体:单斜硫和正交硫。已知常温常压下:
① S (s,单斜)+O2 (g)→SO2 (g)+297.16kJ;
② S (s,正交)+O2 (g)→SO2 (g)+296.83kJ
下列说法正确的是
| A.常温常压下单斜硫比正交硫稳定 |
B.单斜硫转变为正交硫的能量变化可用下图表示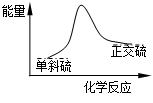 |
| C.S(g)+O2(g)→SO2(g)+Q3 Q3>296.83kJ |
| D.反应①中生成1 L SO2 (g)放出297.16kJ热量 |