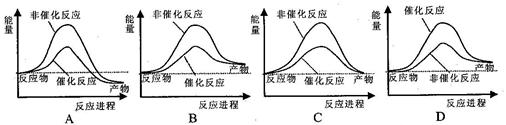
题目内容
下列热化学方程式正确的是(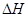 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H= +116.2kJ/mol(反应热) |
C
解析试题分析:A、燃烧热方程式中水应是液态,A错误;B、中和反应是放热反应,△H=-57.3kJ·mol-1,B错误;C、正确;D、未标注物质聚集状态,D错误;选C。
考点:热化学方程式

练习册系列答案
相关题目
已知25℃、101kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s);△H=-2834.9kJ?mol-1
②4Al(s)+2O3(g)=2Al2O3(s);△H=-3119.1kJ?mol-1 由此得出的正确结论是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.反应①可确定铝的燃烧热是708.7KJ |
| C.O3比O2稳定,由O2变O3为放热反应 |
| D.反应②可确定铝的燃烧热是779.78 kJ?mol-1 |
拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) 2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
| A.H-H比N≡N更牢固 |
| B.N≡N键能约为946 kJ/mol |
| C.合成氨反应选择适当的催化剂是为了提高H2的转化率 |
| D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ |
合理利用燃料减小污染符合“绿色奥运”理念,下列关于燃料的说法正确的是( )
| A.“可燃冰”是将水变为油的新型燃料 |
| B.氢气是具有热值高、无污染等优点的燃料 |
| C.乙醇是比汽油更环保、不可再生的燃料 |
| D.石油和煤是工厂经常使用的可再生的化石燃料] |
下列热化学方程式书写正确的是
A.2SO2+O2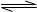 2SO3;ΔH =-196.6kJ/mol 2SO3;ΔH =-196.6kJ/mol |
| B.C(s)+O2(g)=CO2(g);ΔH =393.5kJ/mol |
| C.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.5kJ/mol |
| D.H+(aq)+OH-(aq)=H2O(l);ΔH =57.3kJ/mol |
已知1g氢气完全燃烧生成水蒸气时放出热量12lkJ。且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为
| A.920kJ | B.557kJ | C.436kJ | D.188kJ |
下列热化学方程式中的ΔH能表示可燃物的燃烧热的是
| A.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.3kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH =-802.3kJ/mol |
| C.2H2(g)+O2(g)=2H2O(l);ΔH =-571.6kJ/mol |
| D.CO(g)+1/2O2(g)=CO2(g);ΔH =-283kJ/mol |
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-542.7" kJ·mol-1 |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1059.3" kJ·mol-1 |
C.N2H4(g)+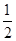 N2O4(g)= N2O4(g)=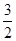 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1076.7" kJ·mol-1 |