题目内容
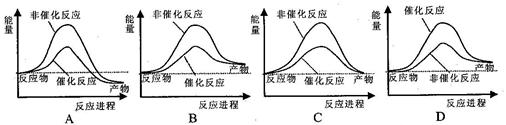
如图所示是101kPa时,氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )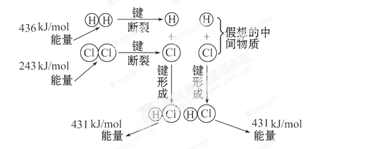
| A.此反应的热化学方程式为:H2(g)+Cl2(g) =2HCl(g) ΔH=+183kJ·mol-1 |
| B.2molHCl分子中的化学键形成时要释放862kJ能量 |
| C.1molH2中的化学键断裂时需要吸收436kJ能量 |
| D.此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g) =HCl(g) ΔH=-91.5kJ·mol-1 |
A
解析试题分析:该反应过程为:H2分子与Cl2分子化学键断裂,吸收能量436kJ/mol+243kJ/mol=679kJ/mol,形成激发态原子。氢原子与氯原子形成HCl放出431kJ/mol×2=862kJ/mol。反应物能量-生成物能量=反应热,故A选项中ΔH=-183kJ·mol-1。 B、C、D解释如上述。
考点:反应热表示方法及计算

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) 2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
| A.H-H比N≡N更牢固 |
| B.N≡N键能约为946 kJ/mol |
| C.合成氨反应选择适当的催化剂是为了提高H2的转化率 |
| D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ |
下列热化学方程式中的ΔH能表示可燃物的燃烧热的是
| A.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.3kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH =-802.3kJ/mol |
| C.2H2(g)+O2(g)=2H2O(l);ΔH =-571.6kJ/mol |
| D.CO(g)+1/2O2(g)=CO2(g);ΔH =-283kJ/mol |
完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是
| A.0.2Q | B.0.1Q | C.5Q | D.10Q |
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-542.7" kJ·mol-1 |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1059.3" kJ·mol-1 |
C.N2H4(g)+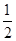 N2O4(g)= N2O4(g)=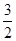 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1076.7" kJ·mol-1 |
某废水处理厂处理废水中NH+的过程如下:
①NH4+(aq)+ O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
②2HNO2(aq)+O2(g)=2NO3-(aq)+2H+ ΔH=-aKJ/mol
下列叙述正确的是( )
| A.将NH4+转化为NO3-的热化学方程式可表示为: NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)ΔH=-(b+  )KJ/mol )KJ/mol |
| B.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
| C.常温下,若HNO3溶液中c(H+)="0.1" mol·L-1,则该溶液的pH>1 |
| D.若上述两次转化完全,不考虑其它杂质离子的存在,则:c(NH4+)+c(OH-)=c(NO3-)+c(H+) |