题目内容
(8分)(1)已知25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为:
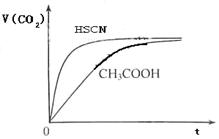
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,将pH=1的H2SO4溶液a mL与pH=12的NaOH溶液b mL混合后,所得溶液的pH=3,则a:b= ;反应后,溶液中各离子浓度由大到小的顺序是 。

反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,将pH=1的H2SO4溶液a mL与pH=12的NaOH溶液b mL混合后,所得溶液的pH=3,则a:b= ;反应后,溶液中各离子浓度由大到小的顺序是 。
(1)HSCN的酸性比CH3COOH强,其溶液中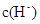 较大,故其溶液与NaHCO3溶液的反应速率快 < (2)1 : 9;c(Na+)>c(SO
较大,故其溶液与NaHCO3溶液的反应速率快 < (2)1 : 9;c(Na+)>c(SO )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
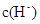 较大,故其溶液与NaHCO3溶液的反应速率快 < (2)1 : 9;c(Na+)>c(SO
较大,故其溶液与NaHCO3溶液的反应速率快 < (2)1 : 9;c(Na+)>c(SO )>c(H+)>c(OH-)
)>c(H+)>c(OH-)(1)根据电离常数可知,HSCN的酸性比CH3COOH强,其溶液中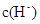 较大,故其溶液与NaHCO3溶液的反应速率快。酸越弱,相应的钠盐越容易水解。即醋酸钠溶液的碱性强于NaSCN溶液的碱性。所以c(CH3COO-)小于c(SCN-)。
较大,故其溶液与NaHCO3溶液的反应速率快。酸越弱,相应的钠盐越容易水解。即醋酸钠溶液的碱性强于NaSCN溶液的碱性。所以c(CH3COO-)小于c(SCN-)。
(2)根据题意硫酸过量,所以有 ,解得a:b="1" : 9。根据电荷守恒c(Na+)+ c(H+)=2c(SO
,解得a:b="1" : 9。根据电荷守恒c(Na+)+ c(H+)=2c(SO )+c(OH-)可知,溶液中各离子浓度由大到小的顺序是c(Na+)>c(SO
)+c(OH-)可知,溶液中各离子浓度由大到小的顺序是c(Na+)>c(SO )>c(H+)>c(OH-)。
)>c(H+)>c(OH-)。
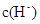 较大,故其溶液与NaHCO3溶液的反应速率快。酸越弱,相应的钠盐越容易水解。即醋酸钠溶液的碱性强于NaSCN溶液的碱性。所以c(CH3COO-)小于c(SCN-)。
较大,故其溶液与NaHCO3溶液的反应速率快。酸越弱,相应的钠盐越容易水解。即醋酸钠溶液的碱性强于NaSCN溶液的碱性。所以c(CH3COO-)小于c(SCN-)。(2)根据题意硫酸过量,所以有
 ,解得a:b="1" : 9。根据电荷守恒c(Na+)+ c(H+)=2c(SO
,解得a:b="1" : 9。根据电荷守恒c(Na+)+ c(H+)=2c(SO )+c(OH-)可知,溶液中各离子浓度由大到小的顺序是c(Na+)>c(SO
)+c(OH-)可知,溶液中各离子浓度由大到小的顺序是c(Na+)>c(SO )>c(H+)>c(OH-)。
)>c(H+)>c(OH-)。
练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 2NH3(g)△H=" —92.4" kJ/mol。
2NH3(g)△H=" —92.4" kJ/mol。 N2O4达到平衡的标志是( )
N2O4达到平衡的标志是( ) xC(g)达到平衡后,C的体积分数为W%。若维持容积和温度不变,按1.4 molA、0.7molB、1.2molC为起始物质,达到平衡后C的体积分数仍为W%,则x的值为:
xC(g)达到平衡后,C的体积分数为W%。若维持容积和温度不变,按1.4 molA、0.7molB、1.2molC为起始物质,达到平衡后C的体积分数仍为W%,则x的值为: 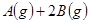

 (正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则
(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则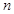 值与压强
值与压强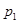 、
、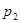 的关系正确的是
的关系正确的是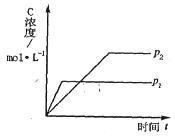
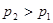 ,
,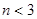
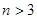
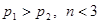
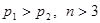
 pC的可逆反应达到平衡:
pC的可逆反应达到平衡: N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的