题目内容
在一定温度下有甲、乙两容积相等的密闭容器(两容器容积保持不变)。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3amol。此时,NH3的物质的量分数是________。(用含有“a”的表达式表示)。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将________(选填“增大”、“减小”或“不变”)。
(2) 若起始时,向乙中通入6mol N2和8mol H2,达到平衡时,生成的NH3的物质的量为b mol, (选填“>”、“<”或“=”)。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3amol。此时,NH3的物质的量分数是________。(用含有“a”的表达式表示)。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将________(选填“增大”、“减小”或“不变”)。
(2) 若起始时,向乙中通入6mol N2和8mol H2,达到平衡时,生成的NH3的物质的量为b mol, (选填“>”、“<”或“=”)。
(6分,每空2分)(1) a /(7-a);增大 (2)<
(1)生成NH3amol,则根据方程式可知,消耗氮气和氢气分别是0.5amol和1.5amol,则剩余氮气和氢气分别是(3-0.5a)mol、(4-1.5a)mol,所以氨气的体积分数是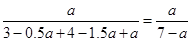 。增大氮气的浓度,平衡向正反应方向移动,但氮气的转化率降低,所以氮气的含量增大。
。增大氮气的浓度,平衡向正反应方向移动,但氮气的转化率降低,所以氮气的含量增大。
(2) 若起始时,向乙中通入6mol N2和8mol H2,则乙相当于在甲的基础上增大氧气,平衡向正反应方向移动,所以b大于2a,即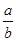 <
<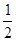 。
。
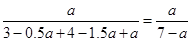 。增大氮气的浓度,平衡向正反应方向移动,但氮气的转化率降低,所以氮气的含量增大。
。增大氮气的浓度,平衡向正反应方向移动,但氮气的转化率降低,所以氮气的含量增大。(2) 若起始时,向乙中通入6mol N2和8mol H2,则乙相当于在甲的基础上增大氧气,平衡向正反应方向移动,所以b大于2a,即
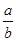 <
<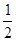 。
。
练习册系列答案
相关题目
 2AB(g)达到平衡状态的标志是( )
2AB(g)达到平衡状态的标志是( ) pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是
pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是 v逆(C)
v逆(C) 2AB(g)达到平衡标志的是
2AB(g)达到平衡标志的是
 2Z(g)
2Z(g) C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须:
C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须: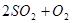
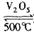
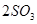 。如果反应在密闭容器中进行,下列说法错误的是
。如果反应在密闭容器中进行,下列说法错误的是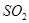 的物质的量不再改变时,该反应达到了平衡状态
的物质的量不再改变时,该反应达到了平衡状态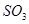 的浓度一定相等
的浓度一定相等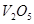 催化剂是为了加快反应速率,提高生产效率
催化剂是为了加快反应速率,提高生产效率