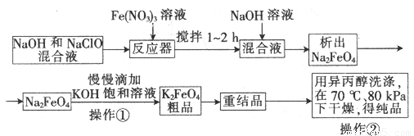
题目内容
下列离子反应方程式正确的是
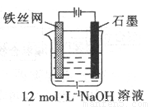
- A.用两个铜电极电解食盐水:2Cl-+2H2O
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ - B.腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+
- C.以铜作电极电解硫酸铜溶液:2Cu2++2H2O
 2Cu+O2↑+4H+
2Cu+O2↑+4H+ - D.AlCl3溶液呈酸性的原因:Al3++3H2O?Al(OH)3+3H+
D
分析:离子方程式是指用实际参加反应的离子符号表示离子反应的式子.离子方程式的书写步骤一般为:
①“写”:写出有关反应的化学方程式;②“拆”:可溶性的电解质用离子符号表示,其它难溶的物质、气体、水等仍用化学式表示;③“删”:删去方程式两边不参加反应的离子; ④“查”:检查式子两边的各种原子的个数及电荷数是否相等;
A.电解池中,金属铜作阳极时,铜电极本身失去电子;
B.方程式左右电荷不守恒;
C.以铜作电极电解硫酸铜溶液金属铜作阳极,铜电极本身失去电子;
D.AlCl3溶液呈酸性是由于铝离子的水解,方程式两边守恒;
解答:A.金属铜作阳极时,铜电极本身失去电子,阳极反应为Cu-2e-=Cu2+,阴极是水中的氢离子放电,故电解原理方程式为Cu+2H2O Cu(OH)2↓+H2↑,故A错误;
Cu(OH)2↓+H2↑,故A错误;
B.方程式左边带3个单位的负电荷,右边带4个单位的正电荷,正确的为:2Fe3++Cu═2Fe2++Cu2+,故B错误;
C.以铜作电极电解硫酸铜溶液,阳极铜电极本身失去电子反应为Cu-2e-=Cu2+,阴极为Cu2++2e-=Cu,故C错误;
D.因AlCl3为强酸弱碱盐,铝离子水解溶液呈酸性,水解是可逆的Al3++3H2O?Al(OH)3+3H+,方程式左右各种原子的个数及电荷数相等,故D正确;
故选D.
点评:本题考查离子方程式的书写,明确发生的反应并熟悉离子反应方程式的书写方法是解答本题的关键,题目难度不大.
分析:离子方程式是指用实际参加反应的离子符号表示离子反应的式子.离子方程式的书写步骤一般为:
①“写”:写出有关反应的化学方程式;②“拆”:可溶性的电解质用离子符号表示,其它难溶的物质、气体、水等仍用化学式表示;③“删”:删去方程式两边不参加反应的离子; ④“查”:检查式子两边的各种原子的个数及电荷数是否相等;
A.电解池中,金属铜作阳极时,铜电极本身失去电子;
B.方程式左右电荷不守恒;
C.以铜作电极电解硫酸铜溶液金属铜作阳极,铜电极本身失去电子;
D.AlCl3溶液呈酸性是由于铝离子的水解,方程式两边守恒;
解答:A.金属铜作阳极时,铜电极本身失去电子,阳极反应为Cu-2e-=Cu2+,阴极是水中的氢离子放电,故电解原理方程式为Cu+2H2O
 Cu(OH)2↓+H2↑,故A错误;
Cu(OH)2↓+H2↑,故A错误;B.方程式左边带3个单位的负电荷,右边带4个单位的正电荷,正确的为:2Fe3++Cu═2Fe2++Cu2+,故B错误;
C.以铜作电极电解硫酸铜溶液,阳极铜电极本身失去电子反应为Cu-2e-=Cu2+,阴极为Cu2++2e-=Cu,故C错误;
D.因AlCl3为强酸弱碱盐,铝离子水解溶液呈酸性,水解是可逆的Al3++3H2O?Al(OH)3+3H+,方程式左右各种原子的个数及电荷数相等,故D正确;
故选D.
点评:本题考查离子方程式的书写,明确发生的反应并熟悉离子反应方程式的书写方法是解答本题的关键,题目难度不大.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案
相关题目
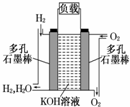 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: .
.
 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O