题目内容
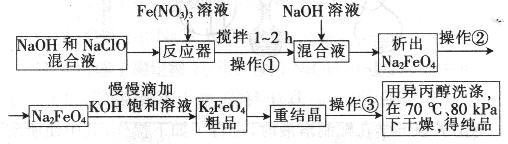
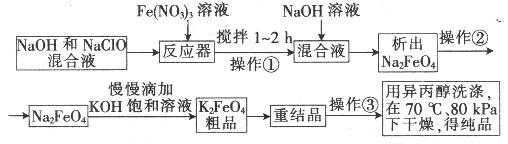
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备流程如下:

试回答下列问题
(1)反应器中,NaOH、NaClO、Fe(NO3)3发生反应生成Na2FeO4,完成并配平下列离子反应方程式:
□Fe3++□ClO─+□OH─ ==□FeO42─+□Cl─+□___________
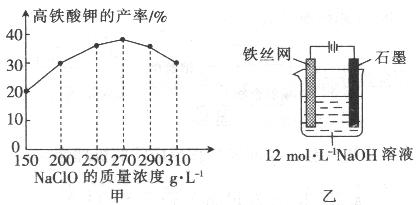
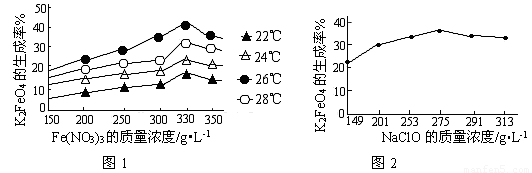
(2)次氯酸钠浓度对高铁酸钾产率有一定影响,当NaClO浓度为298g/L时,高铁酸钠的产率最高,此时NaClO的物质的量浓度为_______________。
(3)你认为操作①能够发生转化的原因是__________,慢慢滴加的原因的是___________。
(4)操作②如果温度过高会造成高铁酸钾的分解,高铁酸钾受热分解时生成金属氧化物和氧气,该反应的化学方程式为__________________。
(5)可以用电化学法制取Na2FeO4,其装置如图所示,则阳极的电极反应式为 ;
阴极的电极反应式为______________;电解一段时间后溶OH─的浓度会_________(填“升高”、“降低”
或“不变”)。

(1) 2Fe3++3ClO─+10OH─=2FeO42─+3Cl─+5H2O
(2)4mol/L(少单位扣1分)
(3)此条件下,高铁酸钾的溶解度小于高铁酸钠的;为了使反应充分(1分)。
(4)4K2FeO4 2K2O+2Fe2O3+3O2↑(缺少条件扣1分)
2K2O+2Fe2O3+3O2↑(缺少条件扣1分)
(5)Fe+8OH-─6e-=FeO42-+4H2O;2H++2e-=H2↑(或2H2O+2e-=2OH-+H2↑);降低(1分)
【解析】
试题分析:(1)根据反应可知,铁元素的化合价从+3价升高到+6价,失去3个电子。氯元素的化合价从+1价降低到-1价,得到2个电子。因此根据电子得失守恒可知,氧化剂次氯酸钠和还原剂硝酸铁的物质的量之比是3:2,根据电荷守恒可知OH-的计量数是10,根据原子守恒可知,生成物中还有水生成,所以反应的离子方程式为2Fe3++3ClO─+10OH─=2FeO42─+3Cl─+5H2O。
(2)NaClO浓度为298g/L,即1L溶液中含有次氯酸钠的质量是298g物质的量=298g÷74.5g/mol=4mol,因此次氯酸钠的物质的量浓度=4mol÷1L=4mol/L。
(3)操作1是向高铁酸钠中溶液慢慢滴加饱和氢氧化钾溶液即可以得到高铁酸钾,因此根据沉淀容易向生成更难溶的方向转化可知,在此条件下,高铁酸钾的溶解度小于高铁酸钠的;为了使反应充分小于慢慢滴加氢氧化钾饱和溶液,以提高原料利用率。
(4)高铁酸钾受热分解时生成金属氧化物和氧气,其中氧元素的化合价从-2价升高到0价,因此氧气是氧化产物,则铁元素的化合价必然降低生成氧化铁,另外还有氧化钾产生,反应的化学方程式为4K2FeO4 2K2O+2Fe2O3+3O2↑。
2K2O+2Fe2O3+3O2↑。
(5)电解池阳极失去电子,发生氧化反应。铁与电源的正极相连,做阳极,因此铁失去电子结合溶液中的OH-生成FeO42-,因此阳极电极反应式为Fe+8OH- ─6e-=FeO42-+4H2O;电解池阴极得到电子,发生还原反应,则在该电解池中溶液中的氢离子在阴极得到电子,电极反应式为2H++2e-=H2↑;根据阴阳极的电极反应式可知该电池反应的总反应方程式为Fe+2OH-+2H2O
 FeO42-+3H2↑,这说明在反应过程中溶液中OH-的浓度降低。
FeO42-+3H2↑,这说明在反应过程中溶液中OH-的浓度降低。
考点:考查高碳酸盐的制备实验探究、实验条件控制、氧化还原反应方程式配平、物质的量浓度计算以及电解原理的应用与计算




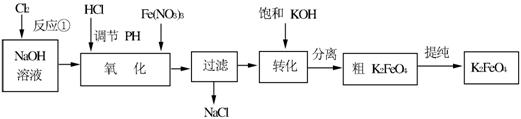
 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。