题目内容
(1)一位同学向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+.
①可观察到实验现象是
②反应过程中发生反应的化学方程式是
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现血红色,但当滴加过量新制氯水时,却发现红色褪去.为了弄清溶液红色褪去的原因,同学们查到如下资料:
①铁有一种化合物称为铁酸盐(含有FeO42-).
②SCN-的电子式为
 .
.③氯水具有很强的氧化性.
于是同学们提出两种假设,
①第一种假设是:Cl2可将Fe3+氧化为FeO42-,请写出该离子反应方程式
②第二种假设是:
II.某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染.请填写下列空白:

(1)写出钛铁矿经氯化得到四氯化钛的化学方程式:
| ||
| ||
(2)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2t甲醇,至少需额外补充H2
(3)用甲醇-空气碱性(KOH)燃料电池作电源电解精炼粗铜,在接通电路一段时间后纯Cu质量增加3.2g.
①请写出燃料电池中的负极反应式:
②燃料电池正极消耗空气的体积是
(2)①根据Cl2做氧化剂被还原生成氯离子,Fe3+被氧化为FeO42-,确定反应物和生成物,然后根据化合价升降总数相等和原子守恒配平;
②SCN-中S为负二价,N为负三价均为最低价有被氧化的可能,溶液的颜色会逐渐褪去,可能溶液中的SCN-被过量的氯水氧化;
II.(1)分析流程可知,钛铁矿经氯化得到四氯化钛、氯化铁和一氧化碳,依据原子守恒配平写出;
(2)①依据浓度商和平衡常数比较分析判断反应进行的方向;
②根据CO和H2合成甲醇的方程式:CO(g)+2H2(g)?CH3OH(g)以及2FeTiO3+6C+7Cl2
| ||
| ||
(3)①根据负极反应=总反应-正极反应来回答;
②根据电路中的电子守恒来计算回答.
故答案:产生白色沉淀,迅速变灰绿色,最终变红棕色沉淀;
②涉及的反应方程式为:FeCl2+2NaOH═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:FeCl2+2NaOH═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(2)①Cl2做氧化剂被还原生成氯离子,Fe3+被氧化为FeO42-,根据化合价升降总数相等和原子守恒得:2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+,
故答案为:2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+;
②SCN-中S为负二价,N为负三价均为最低价有被氧化的可能,溶液的颜色会逐渐褪去,可能溶液中的SCN-被过量的氯水氧化,
故答案为:SCN-被Cl2氧化;
II.(1)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2
| ||
故答案为:2FeTiO3+6C+7Cl2
| ||
(2)①将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此状态的浓度熵Qc=
| c(CH3OH) |
| c(CO).c2(H2) |
| ||||
|
故答案为:向逆反应方向进行;
②由方程式CO(g)+2H2(g)?CH3OH(g)、2FeTiO3+6C+7Cl2
| ||
| ||
(3)①甲醇-空气碱性(KOH)燃料电池的总反应为:3O2+2CH3OH+4OH-=2CO32-+6H2O,正极反应式为:3O2+12e-+6H2O=12OH-,负极反应=总反应-正极反应,即为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②电解精炼粗铜时,阴极电极反应为:Cu2++2e-=Cu,当生成3.2g纯铜,至少转移电子0.1mol,燃料电池的正极反应为:3O2+12e-+6H2O=12OH-,转移电子0.1mol,消耗氧气0.025mol,折合成空气为0.125mol,在标准状况下的体积为2.8L,
故答案为:2.8 L.

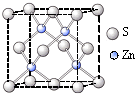
A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为 ?? ,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于 ?? ,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是 ?? 。
(2)当n=2时,B原子的结构示意图为 ?? ,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为 ?? ,该晶体中最小的环共有 ?? 个微粒构成,微粒间的作用力是 ?? 。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是 ?? ,A、B、C、D四种元素的第一电离能由大到小的顺序是
?? (用元素符号表示)。
B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
 (1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
| 编号 | I | II | III | IV | V |
| V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
| V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
| 现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭 不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为 ?? 。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答: ?? (填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答: ?? (“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
| a | 在烧瓶中加热适量浓HNO3 4HNO3 △ 4NO2↑+O2↑+2H2O↑ | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
| b | 加热AgNO3固体 2AgNO3 △ 2NO2↑+O2↑+2Ag | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
| c | 加热Cu(NO3)2固体 2Cu(NO3)2 △ 4NO2↑+O2↑+2CuO | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a. ?? ,原因是 ?? 。
b. ?? ,原因是 ?? 。
c. ?? ,原因是 ?? 。
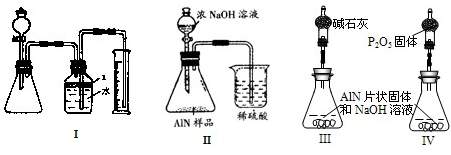





 2AlN+3CO
2AlN+3CO