题目内容
19世纪门捷列夫的突出贡献是
| A.提出了原子学说 | B.提出了分子学说 |
| C.发现了稀有气体 | D.发现了元素周期律 |
D
解析试题分析:1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循。A、道尔顿提出了近代原子学说,故A错误;B、阿佛加德罗提出了分子学说,故B错误;C、英国化学家莱姆赛发现了稀有气体,故C错误;D、1869年,俄国化学家门捷列夫发现了元素周期律,故D正确,故选D。
考点:考查化学史

练习册系列答案
相关题目
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是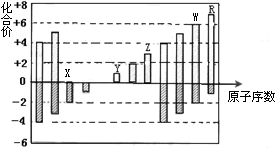
| A.原子半径:Z>Y>X |
| B.气态氢化物的还原性:W>R |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.含Z的盐溶液一定显示酸性 |
下列叙述中错误的是( )
| A.原子半径:Na>Si>Cl | B.稳定性:SiH4<HCl<H2S |
| C.金属性:Na>Mg>Al | D.酸性:H3PO4<H2SO4<HClO4 |
已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径A>B>D>C | B.原子序数 d > c > b > a |
| C.离子半径C>D>B>A | D.单质的还原性A>B>D>C |
短周期元素X、Y、Z的原子序数依次增大,Y为ⅠA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13,下列判断正确的是( )
| A.Y元素位于第2周期 | B.Y、Z均能与X形成不只一种化合物 |
| C.X是VA族元素 | D.氢化物的稳定性:HnZ > HnX |
W、X、Y、Z、R属于短周期元素。已知它们都不是稀有气体元素,W的原子半径是所属周期中最大,X元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,Z元素与Y元素同主族,R元素原子与X元素原子的核外电子数之比为2∶1。下列叙述中,错误的是
| A.分别由Y、Z组成的单质一定都为原子晶体 |
| B.W与X形成的两种化合物中阴、阳离子的个数比均为1∶2 |
| C.Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D.X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物低 |
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )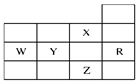
| A.W元素最高价含氧酸酸性强于Y元素最高价含氧酸酸性 |
| B.Z的阴离子电子层结构与R原子的相同 |
| C.p能级未成对电子数最多的是Z元素 |
| D.X元素是电负性最大的元素 |
下列排列顺序不正确的是
| A.熔点:Al>K>Na | B.微粒的半径:Cl- >Na+>Mg2+>Al3+ |
| C.热稳定性:HF>HCl>HBr>HI | D.结合质子能力:AlO-2>CO32->F- |