题目内容
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )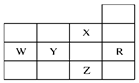
| A.W元素最高价含氧酸酸性强于Y元素最高价含氧酸酸性 |
| B.Z的阴离子电子层结构与R原子的相同 |
| C.p能级未成对电子数最多的是Z元素 |
| D.X元素是电负性最大的元素 |
D
解析试题分析:有元素在周期表中位置可确定这几种元素分别是:X是F;Y是S;Z是Br;W是P;R是Ar。A.非金属性S>P ,所以H2SO4>H3PO4。错误。B.Br元素的阴离子Br-电子层结构与R下邻的原子的相同,但是比Ar多18个电子。错误。C.p能级未成对电子数最多的是P元素。错误。D.在元素周期表中,题意周期的的元素,随着原子序数的增大,元素的非金属性逐渐增强,所以同一周期的元素非金属性最强的在元素周期表的最右边(惰性气体元素除外)。在同一主族中从上到下,元素的非金属性逐渐减弱。所以同一主族中非金属性最强的在最上边。因此在这几种元素中非金属性最强的的F。元素的非金属性越强,其电负性就最大。所以F元素是电负性最大的元素。正确。
考点:考查原子的结构及元素周期表、元素周期律的应用的知识。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
19世纪门捷列夫的突出贡献是
| A.提出了原子学说 | B.提出了分子学说 |
| C.发现了稀有气体 | D.发现了元素周期律 |
某元素的原子最外电子层排布是5s25p1,该元素或其化合物不可能具有的性质是 ( )
| A.该元素单质是导体 |
| B.该元素单质在一定条件下能与盐酸反应 |
| C.该元素的最高化合价呈+5价 |
| D.该元素的氧化物的水合物显碱性 |
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是
| A.镭比钙的金属性更强 | B.在化合物中呈+2价 |
| C.镭是一种放射性元素 | D.氢氧化镭呈两性 |
能说明A元素的非金属性比B元素的非金属性强的是:
| A.A原子得到电子的数目比B原子少 |
| B.A元素的最高正价比B元素的最高正价要高 |
| C.气态氢化物溶于水后的酸性:A比B强 |
| D.A单质能与B的氢化物水溶液反应,生成B单质 |
W、X、Y、Z是短周期元素,其部分性质如下表
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的2/3 |
| Z | 第三周期原子半径最小的金属 |
下列说法正确的是
A.气态氢化物的热稳定性:X>W
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.Z的氧化物中含有非极性共价键
下列关于元素周期表的说法中正确的是
| A.元素周期表有8个主族 |
| B.ⅠA族的元素全部是金属元素 |
| C.元素周期表有7个周期 |
| D.短周期是指第1、2周期 |
下列说法正确的是
| A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 |
| B.只有非金属能形成含氧酸或含氧酸盐 |
| C.除稀有气体外的非金属元素都能生成不同价态的含氧酸 |
| D.非金属的最高价含氧酸都具有强氧化性 |
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如下图。下列说法正确的是
| | X | | Y | |
| | | | W | |
| | | | | |
A.五种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.Y的简单阴离子比W的简单阴离子还原性强
D.Z与Q形成的化合物水溶液一定显酸性