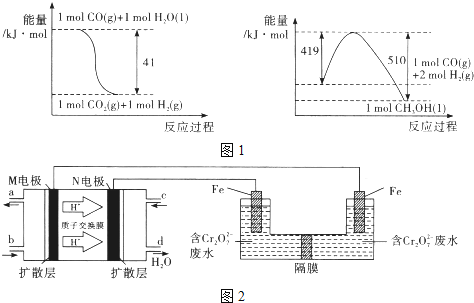
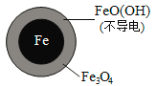
题目内容
【题目】已知A、B、C、D是原子序数依次减小的四种短周期元素,C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;A原子有2个未成对电子;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与D原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为__________________;
(2)M分子中C原子轨道的杂化类型为__________________;
(3)E+的核外电子排布式为__________________1s22s22p63s23p63d10
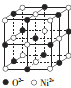
,下图是由D、E形成的某种化合物的晶胞结构示意图,该化合物的化学式为__________________;
(4)化合物BD3的沸点比化合物CA4的高,其主要原因是__________________;
(5)写出与CA2互为等电子体的B3-的结构式 __________________;
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是__________________(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
【答案】(1)N>O>C (2)sp2(3)1s22s22p63s23p63d10Cu2O (4)NH3分子间能形成氢键
(5)[N=N=N]-(6)A、C
【解析】试题分析:C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,核外电子排布为1s22s22p2,则C是C元素;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,该气体M为HCHO,A原子有2个未成对电子,则D为H元素、A为O元素;B的原子序数介于碳、氧之间,故B为N元素;E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满,核外电子排布为1s22s22p63s23p63d104s1,则E是铜元素;
(1)同周期随原子序数增大,第一电离能呈增大趋势,但N原子2p轨道半满,为稳定状态,第一电离能共有同周期相邻元素,故第一电离能:N>O>C;
(2)M为HCHO,分子中C原子成3个σ键,没有孤电子对,杂化轨道数目为3,则C原子采取sp2杂化;
(3)Cu失去4s能级1个电子形成Cu+,基态核外电子排布式为1s22s22p63s23p63d10,由晶胞结构可知,Cu+位于晶胞内部,晶胞中含有4个Cu+,O原子数为8×+1=2,则O与Cu+数目比为1:2,化学式为Cu2O;
(4)NH3分子间能形成氢键,甲烷分子之间为分子间作用力,氢键比分子间作用力强,故NH3的沸点比CH4的高;
(5)CO2、N3-互为等电子体,二者结构相似,N3-中N原子之间形成2对共用电子对,N3-的结构式[N=N=N]-;
(6)A.电解质在水溶液里电离出阴阳离子,所以该离子中不存在离子键,故选;B.水分子或[Cr(H2O)5Cl]2+中,非金属元素之间都存在共价键,故不选;C.该溶液中不存在金属键,故选;D.[Cr(H2O)5Cl]2+中Cr原子和水分子中的O原子之间存在配位键,故不选;E.溶液中水分子之间存在范德华力,故不选;故选A、C。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
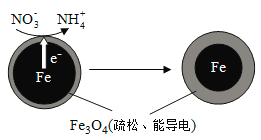
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
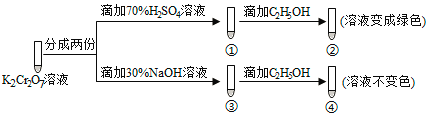
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
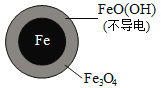
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
pH =4.5(其他条件相同)

(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。