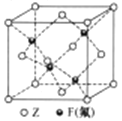
题目内容
【题目】氢能是发展中的新能源,它的利用包括氯的制备、应用等环节。回答下列问题:
(1)氢气的制备
以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。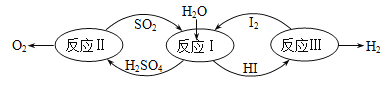
反应Ⅱ包含两步反应:
①H2SO4(1)=SO3(g)+H2O(g) ΔH=177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H=196kJ/mol
写出反应Ⅱ的热化学反应方程式__________
(2)氯气的应用
CO2加氢制备甲酸(HCOOH)可用于回收利用CO2。温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)![]() HCOOH(g) △H,化学平衡常数K=1
HCOOH(g) △H,化学平衡常数K=1
实验测得:v正=k正·c(CO2)·c(H2), v逆=k逆·c(HCOOH),k正、k逆为速率常数。
①当CO2的转化率为33.3%时,HCOOH的体积分数为_____(保留整数)。
②T1时,k逆=_________(用k正表示)。当升高温度至T2时,k逆=0.9k正,则△H____0(填“>”、“<"或“=”)。
③采用电还原法也可将CO2转化为甲酸根,用Sn为阴极、Pt为阳极,KHCO3溶液为电解液进行电解。CO2应通入______区(填“阳极”或“阴极”),其电极反应式为__________
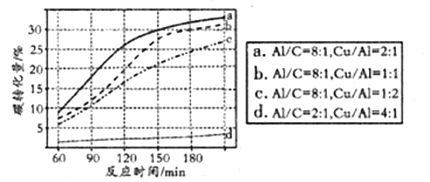
④可用NaHCO3代替CO2作为碳源加氢制备甲酸。向反应器中加入NaHCO3水溶液、A1粉、Cu粉,在300℃下反应。NaHCO3用量一定时,Al、Cu的用量对碳转化量影响结果如图。由图可知,曲线d相对其它三条曲线碳转化量变化不大的主要原因是__________,当碳转化量为30%时所采用的实验条件是____________。
 。
。
【答案】 2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=550kJ/mol 20% k正 > 阴极 2CO2+2e-+H2O=HCOO-+HCO3- Al的用量对碳转化量影响较大,曲线d中Al的用量少 150min,a180min,b
【解析】(1)反应①+②可以得出反应Ⅱ的热化学反应方程式:2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=550kJ/mol
(2)①假设加入的二氧化碳和氢气均为1mol,CO2的转化率为33.3%,那么生成HCOOH0.33mol,剩余二氧化碳和氢气物质的量为0.667mol,HCOOH的体积分数为![]() ;
;
②已知v正=k正·c(CO2)·c(H2), v逆=k逆·c(HCOOH),当达到化学平衡时v正=v逆,所以k正·c(CO2)·c(H2)=k逆·c(HCOOH),可得![]() ,又因为K=1,所以得出k正·=k逆;当升高温度至T2时,k逆=0.9k正,说明平衡正向移动,正向吸热,△H>0。
,又因为K=1,所以得出k正·=k逆;当升高温度至T2时,k逆=0.9k正,说明平衡正向移动,正向吸热,△H>0。
③CO2转化为甲酸根C原子的化合价降低,得到电子,应该在阴极发生反应,所以CO2应通入阴极,电极反应式为2CO2+2e-+H2O=HCOO-+HCO3-
④曲线d相对其它三条曲线碳转化量变化不大的主要原因是:Al的用量对碳转化量影响较大,曲线d中Al的用量少;通过图像可知,当碳转化量为30%时所采用的实验条件是:150min,a180min,b。

【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D