题目内容
6.某些地区在地表或很浅的地表层内,存在硝酸钾或芒硝矿(Na2SO4•10H2O),该地区的气候特点是( )| A. | 湿热 | B. | 湿润 | C. | 干旱 | D. | 多雨 |
分析 由于气候干燥,蒸发量大,某些地区在地表或很浅的地表层内易形成矿产工业,主要为石盐、天然碱和芒硝三种主要优势矿产,据此分析.
解答 解:由于气候干燥,蒸发量大,某些地区在地表或很浅的地表层内易形成矿产工业,主要为石盐、天然碱和芒硝三种主要优势矿产,所以该地区的气候特点是干旱,故选:C.
点评 本题主要考查了硝酸钾或芒硝矿的性质,主要是根据性质判断其地区的气候特点,难度不大.

练习册系列答案
相关题目
16.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
| A. | 其分子空间结构类似三氯化氮 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子呈平面三角形,属非极性分子 | |
| D. | 氯化硼液态时能导电而固态时不导电 |
14.下列化学用语正确的是( )
| A. | 硫的原子结构示意图: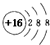 | |
| B. | NH4Br的电子式: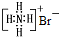 | |
| C. | Be2+离子中的质子数和电子数之比为2:1 | |
| D. | 中子数为146、原子序数为92的铀(U)原子:${\;}_{92}^{146}$U |
11.下列说法不正确的是( )
| A. | 利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气,该方法符合绿色化学原则 | |
| B. | 12C、13C和14C互为同位素,它们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| C. | 超高分辨荧光显微镜可以观察到纳米世界,其中利用了荧光蛋白,生物发光也与荧光蛋白有关,生物发光是将化学能转化为光能的过程 | |
| D. | 分子筛中有许多笼状空穴和通道可用于分离、提纯气体,还可用作干燥剂、离子交换剂、催化剂和催化剂载体 |
8.下列有关化学与自然资源的开发利用描述中错误的是( )
| A. | 用H2作为燃料的优点之一是燃烧后的产物不污染环境 | |
| B. | 要使海水淡化通常有蒸馏法和离子交换法 | |
| C. | 冶炼金属铝通常用电解氯化铝的方法 | |
| D. | 煤的干馏属于化学变化 |
9.下列有关化工生产的说法中不正确的是( )
| A. | 工业上用电解熔融的氯化物的方法制备金属镁和铝 | |
| B. | 适当提高合成氨原料气中N2的含量,可提高H2的转化率 | |
| C. | 从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利 | |
| D. | 利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3 | |
| E. | 硫酸厂生产时常采有高压条件提高SO2的转化率 |
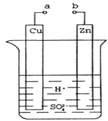 原电池是化学对人类的一个重大贡献.
原电池是化学对人类的一个重大贡献.
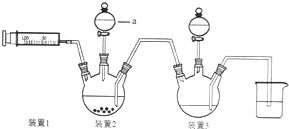 二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图:
二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图: