题目内容
8.下列离子方程式正确的是( )| A. | 足量的SO2通入氨水中:SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| B. | SO2通入溴水中:Br2+SO2+2H2O═2H++SO42-+2HBr | |
| C. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 酸雨久置pH变小:2H2SO3+O2═4H++2SO42- |
分析 A.反应生成亚硫酸氢铵;
B.发生氧化还原反应生成硫酸和HBr,HBr为强酸;
C.发生氧化还原反应生成硫酸钙;
D.亚硫酸被氧化生成硫酸,酸性增强,pH减小.
解答 解:A.足量的SO2通入氨水中的离子反应为SO2+NH3•H2O═NH4++HSO3-,故A错误;
B.SO2通入溴水中的离子反应为Br2+SO2+2H2O═4H++SO42-+2Br-,故B错误;
C.少量SO2通入漂白粉溶液中的离子反应为SO2 +3ClO-+Ca2++H2O=CaSO4↓+Cl-+2HClO,故C错误;
D.酸雨久置pH变小的离子反应为2H2SO3+O2═4H++2SO42-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
19.用两个-X取代基和一个-Y取代基同时取代苯分子中3个氢原子,取代产物有( )
| A. | 4种 | B. | 6种 | C. | 10种 | D. | 14种 |
16.某同学按如图所示的装置进行电解实验.下列说法中不正确的是( )


| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主要反应方程式为:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一段时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度不断减小 |
13.某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验.
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
①由上述实验可知:溶液中Fe元素的存在形式有Fe2+、Fe3+.
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑.进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
提示:KSCN中S元素的化合价为-2价
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑.进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化.再加入H2O2溶液,红色很快褪去 |
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
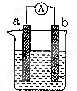
20.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图,下列说法不正确的是( )


| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极b移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |
17.Na、Mg、Al三种金属各2mol分别跟1L 1mol?L-1的盐酸反应时,相同条件下放出氢气体积最大的是( )
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
 根据右图回答下列问题:
根据右图回答下列问题: