��Ŀ����
����Ŀ��ij�����Ĺ�ҵ��ˮ�к��д�����FeSO4���϶��CuSO4������Na2SO4��Ϊ�˼�����Ⱦ�����Ϊ���������ƻ��Ӹ÷�ˮ�л������������ͽ���ͭ���������������ͼ����ɻ�������������ͭ��ʵ�鷽�������ɹ�ѡ����Լ�Ϊ���ۡ�ϡH2SO4��NaOH��Һ���Լ���
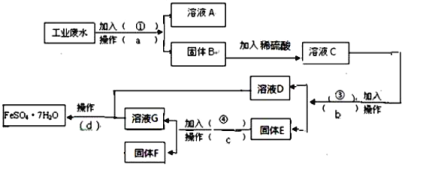
��1������a������Ϊ___������Ҫ�IJ����������ձ����Ҫ___��
��2������E�ijɷ�Ϊ___�������Լ���ʱ�����Ļ�ѧ����ʽΪ___��
��3�������Լ��ٵ�Ŀ����___��
��4������ҺD����ҺG�еõ�FeSO4��7H2O����IJ���Ϊ����Ũ����___��___��ϴ�ӡ����
��5������ˮ����������������ͭ����������ɵĻ����Һ������c(Cu2��)��0.1mol/L��c(Fe2��)��0.4mol/L��c(SO42-)��0.6 mol/L����֪������Ũ�Ⱥ��Բ��ƣ���c(Na��)Ϊ___��
���𰸡����� ©���������� Fe��Cu Fe+H2SO4=FeSO4+H2�� ����Һ�е�Fe2+��Cu2+ת��Ϊ�����������뺬��Na+����Һ���� ��ȴ�ᾧ ���� 0.2mol/L
��������
��ҵ��ˮ���ȼ����������������Һ�����˵õ�Cu(OH)2��Fe(OH)2��������Һ��Na2SO4��NaOH��Һ����Cu(OH)2��Fe(OH)2�мӹ���ϡH2SO4����ҺC�ijɷ�ΪCuSO4��FeSO4��H2SO4������Һ�мӹ����������˳�Fe��Cu����ҺD��FeSO4���ڹ���E�мӹ���ϡH2SO4�����˳�Cu��ʵ���˻��ս���ͭ����ҺG��FeSO4��H2SO4�������Һ��һ�飬��������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӡ�����õ�FeSO47H2O�����������������ݴ˽����⡣
��1������aΪ���ˣ����ڷ�������Һ�壬���˵õ�Cu(OH)2��Fe(OH)2�������õ��IJ���������©�������������ձ���
�ʴ�Ϊ�����ˣ�©������������
��2������E�ijɷ�ΪFe��Cu���ɼ������ᣬ�������ᷴӦ�����������������˳�Cu��ʵ�ֻ��ս���ͭ����Ӧ�Ļ�ѧ����ʽΪFe+H2SO4=FeSO4+H2����
�ʴ�Ϊ��Fe��Cu��Fe+H2SO4=FeSO4+H2����
��3���Լ���ӦΪ�������ƣ��ɽ���Һ�е�Fe2+��Cu2+ת��Ϊ�����������뺬��Na+����Һ���룻
�ʴ�Ϊ������Һ�е�Fe2+��Cu2+ת��Ϊ�����������뺬��Na+����Һ���룻
��4������ҺD����ҺG�еõ�FeSO4��7H2O����IJ���Ϊ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
�ʴ�Ϊ����ȴ�ᾧ�����ˣ�
��5����Һ�ʵ����ԣ����ݵ���غ��֪��2c(Cu2��)+2c(Fe2��)+c(Na��)=2c(SO42-)��c(Na��)= 2��0.6 mol/L-2��0.1mol/L-2��0.4mol/L=0.2mol/L��
�ʴ�Ϊ��0.2mol/L��












