题目内容
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约___mol·L-1(小数点后保留一位)。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___mol·L-1。
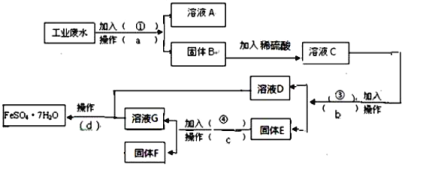
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。需要称量NaClO固体的质量为__g。下列为打乱了的操作示意图,其正确排序为____。

(4)配制过程中下列各项操作对消毒液物质的量浓度有和影响(填“偏小”、“偏大”或“无影响”)
A.用托盘天平称量NaClO固体时,砝码生锈___。
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水____。
C.定容时,俯视容量瓶刻度线进行定容____。
【答案】4.0 0.04 149 ③④①⑥②⑤ 偏大 无影响 偏大
【解析】
(1)依据![]() 计算该“84消毒液”的物质的量浓度;
计算该“84消毒液”的物质的量浓度;
(2)根据稀释前后溶质物质的量不变进行计算;
(3)配制480mL含NaClO的消毒液,应用500mL容量瓶,实际上配制的是500mLNaClO溶液,再依据公式n=cV,m=nM计算NaClO的质量;依据配制一定物质的量浓度溶液的一般步骤排序;
(4)依据配制一定物质的量浓度溶液的正确操作步骤判断,根据![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断。
分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)该“84消毒液”的物质的量浓度约为![]()
故答案为:4.0;
(2)已知该“84消毒液”通常稀释100倍(体积之比)后使用,由(1)知该“84消毒液”的浓度约为4.0mol/L,稀释前后钠离子物质的量不变,则c(Na+)原V= c(Na+)稀释×100V,则稀释后的溶液中c(Na+)稀释=0.04mol·L-1;
故答案为:0.04;
(3)配制480mL含NaClO质量分数为25%的消毒液,应用500mL容量瓶,实际上配制的是500mLNaClO溶液,则NaClO的物质的量为n=cV=0.5L×4.0mol/L=2mol,质量m=nM=2mol×74.5g/mol=149g;配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以正确的操作排序为:③④①⑥②⑤;
故答案为:149;③④①⑥②⑤;
(4)A.用托盘天平称量NaClO固体时,砝码生锈,称得的NaClO质量偏大,则溶液浓度偏大;
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,无影响;
C.定容时,俯视容量瓶刻度线进行定容,导致溶液体积偏小,配制溶液的浓度偏大;
故答案为:偏大;无影响;偏大。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 植物油和溴水混合后振荡、静置 | 溶液分层,溴水褪色 | 植物油萃取了溴水中的Br2 |
B | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中 | 溶液变黄色 | H2O2的氧化性比Fe3+弱 |
C |
| 出现白色沉淀 | 氨气、二氧化碳与饱和食盐水反映生成碳酸钠 |
D | 将盛有铜与浓硫酸的试管加热,发现试管底部出现白色固体,倒去试管中液体,再加入适量水 | 白色固体溶解,溶液显蓝色 | 白色固体为无水硫酸铜 |
A. AB. BC. CD. D
【题目】现使用酸碱中和滴定法测定市售白醋的含酸量(g/100 mL)。
Ⅰ、实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(4)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ、实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ、数据处理与讨论:
(1)按正确数据处理,可得市售白醋含酸量=________g/100 mL(结果保留四位有效数字)。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出