题目内容
已知氮元素有许多化合价,其化合价有-3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
通过分析上表可得出的结论是:当硝酸与金属M反应时,________________。
金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是________。
(2)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示: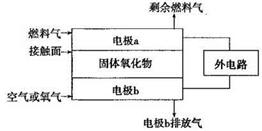
①该电池工作时的总反应为______ __
②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。
③该电池工作时,在接触面上发生的电极反应为________。
(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。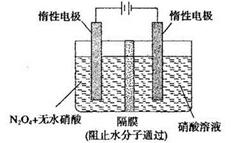
(1)硝酸的浓度或温度不同,硝酸的还原产物也不同; 1:10
(2)4NH3+3O2=2N2+6H2O;由电极b向电极a;2NH3+3O2—-6e-=N2+3H2O
(3)N2O4+2HNO3-2e-=2N2O5+2H+
解析试题分析:(1)分析表格,可知硝酸的浓度及反应温度不同,硝酸的还原产物也不同。
Zn与硝酸反应无气体产生,说明硝酸的还原产物为NH4NO3,据此可此而出方程式:4Zn+10HNO3=4Zn(NO3)3+NH4NO3+3H2O,生成NH4NO3中NH4+的硝酸是被还原的硝酸,其与参与反应的硝酸的物质的量之比为1:10。
(2)电池总反应是NH3和O2反应,生成N2和H2O。
在原电池电解质中,阴离子移向负极,阳离子移向正极,燃料电池通入燃料的a极为负极,通入空气的b极为正极,因此O2-由b移向a。
接触面上发生的反应是负极的燃料NH3失电子,与电解质O2-结合生成N2和H2O。
(3)电解时,阳极失电子,因此N2O4和HNO3失电子产生N2O5。
考点:考查氧化还原反应,燃料电池,电解池,电极反应式书写。

 阅读快车系列答案
阅读快车系列答案(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是____________________________
②属于分解反应,但不是氧化还原反应的是__________________________
③属于化合反应,但不是氧化还原反应的是__________________________
④不属于四种基本反应类型的氧化还原反应的是______________________
A.(NH4)2SO3  2NH3↑+H2O+SO2↑ 2NH3↑+H2O+SO2↑ |
| B.2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O |
C.2C+SiO2  Si+2CO↑ Si+2CO↑ |
D.NH4NO3  N2O↑+2H2O N2O↑+2H2O |
F.MnO2+4HCl(浓)
 MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O(2)对于反应:K2Cr2O7+HCl → KCl+CrCl3+Cl2↑+H2O,回答下列问题:
①配平方程式,并用单线桥表示此反应转移的电子数目及方向
____K2Cr2O7+____HCl ="____KCl" +____ CrCl3+____Cl2↑+____H2O
②若反应中,发生氧化反应的HCl为1.2 mol,则被还原的K2Cr2O7 物质的量为___________mol。
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 。 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
| 起始浓度( mol/L) | C(NH3) | C(O2) | C(NO) | C(H2O) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
①恒温恒容下,平衡时NH3的转化率甲 乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x= ,y= ,z= .
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)
 N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_ a2。A.大于 B.小于 C.等于 D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是 。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式: 。反应过程中,氧化剂和还原剂物质的量之比为 。
(2)若反应中生成0.2mol HNO3,转移的电子数目为 。
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe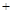 NaNO2
NaNO2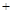 5NaOH → 3Na2FeO2
5NaOH → 3Na2FeO2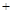 H2O
H2O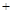 NH3↑
NH3↑
② Na2FeO2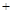 NaNO2
NaNO2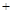 H2O → Na2Fe2O4
H2O → Na2Fe2O4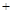 NH3↑
NH3↑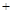 NaOH
NaOH
③Na2FeO2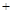 Na2Fe2O4
Na2Fe2O4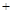 2H2O
2H2O Fe3O4
Fe3O4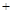 4NaOH
4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,被还原的是 。若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是…………………………………………( )
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、 NaHSO4 |
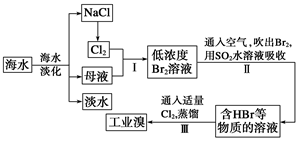
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。
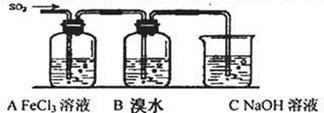
(1)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是 。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | | SO2与Fe3+反应生成了Fe2+ |
| 方案③ | 往第二份试液中加入 | | SO2与Fe3+反应生成了SO42— |
上述方案①得出的结论是否合理 ,原因 。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是 。