题目内容
13.HNO3中N原子轨道的杂化类型为( )| A. | sp1 | B. | sp2 | C. | sp2 | D. | sp3 |
分析 计算HNO3中氮原子价层电子对数,进而确定N原子轨道的杂化类型.
解答 解:HNO3中氮原子价层电子对数为3+$\frac{5+1-2×3}{2}$=3,N原子轨道的杂化类型为sp2,
故选C.
点评 本题考查了杂化类型的判断,题目难度不大,注意把握成键电子对数和孤电子对数的计算方法.

练习册系列答案
相关题目
3.下列化学方程式书写错误的是( )
| A. | 乙醇催化氧化制取乙醛:2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 苯与浓硫酸、浓硝酸的混合液共热制硝基苯: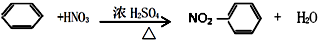 | |
| C. | 乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3 | |
| D. | 乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br-CH2Br |
4.我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述正确的是( )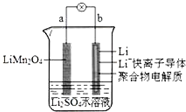

| A. | a为电池的负极 | |
| B. | 放电时,溶液中的Li+从a向b迁移 | |
| C. | 放电时,a极锂元素的化合价发生变化 | |
| D. | 电池充电反应为LiMn2O4=Li1-xMn2O4+xLi |
1.下列有关电子排布图的表述正确的是( )
| A. | 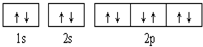 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 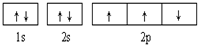 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 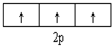 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
8.有关氢键的叙述正确的是( )
| A. | 每一个水分子内平均含有两个氢键 | |
| B. | 氢键与配位键一样,也是共价键的一种 | |
| C. | 氢键是导致浓硫酸具有粘稠性原因之一 | |
| D. | 由于H2O中含有氢键,因此水是一种非常稳定的化合物 |
5.下列说法正确的是( )
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
2.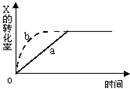 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )| A. | 增大体积 | B. | 增大Y的浓度 | C. | 缩小体积 | D. | 降低温度 |
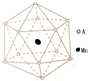 准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构.
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构. .
.