题目内容
3.(1)写出砷的元素符号As,原子中所有电子占有18个轨道,核外共有33个不同运动状态的电子.(2)写出Ni的元素名称镍,该元素在周期表的位置为第四周期,第VIII族.
(3)第四周期基态原子中未成对电子数最多的元素是铬,该元素基态原子的价电子轨道表示式为
 .
.(4)第三电子层上有3个能级,作为内层最多可容纳18个电子,作为最外层时,最多可含有3个未成对电子.
分析 (1)砷的元素符号为As,是第33号元素,核外有33个电子,
(2)镍的元素符号位Ni,在周期表中的第4周期,第VIII族;
(3)第四周期元素中,外围电子排布为ndxnsy,且能级处于半满稳定状态时,含有的未成对电子数最多,据此解答;
(4)第三电子层上有S、P、d三个能级,每个电子层最多容纳2n2个电子,作为最外层时,当3P轨道填充3电子时未成对电子最多.
解答 解:(1)砷的元素符号为As,是第33号元素,核外有33个不同运动状态的电子,其核外电子排布为:1S22S22P63S23P64S23d104S24P3,即有18个轨道,
故答案为:As;18;33;
(2)镍的元素符号位Ni,在周期表中的第4周期,第VIII族,故答案为:镍;四;VIII;
(3)第四周期元素中,外围电子排布为ndxnsy,且能级处于半满稳定状态时,含有的未成对电子数最多,即外围电子排布为3d54s1,此元素为铬,其基态原子的价电子轨道表示为 ,故答案为:铬;
,故答案为:铬; ;
;
(4)第三电子层上有S、P、d三个不同的能级,由于每个电子层最多容纳2n2个电子,故当第三层作为内层时,最多可容纳18个电子,作为最外层时,当3P轨道仅填充3电子时未成对电子最多,有3个未成对电子,故答案为:3;18;3.
点评 本题考查核外电子排布规律等,难度不大,理解核外电子排布规律,注意能级处于全满、半满、全空时的稳定状态.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.HNO3中N原子轨道的杂化类型为( )
| A. | sp1 | B. | sp2 | C. | sp2 | D. | sp3 |
14.下列说法中,不正确的是( )
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 吸热反应一定需要加热的条件 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 反应物和生成物总能量的相对大小决定化学反应放出还是吸收能量 |
18.下列关于丙炔(CH3-C≡CH)的说法正确的是( )
| A. | 丙炔分子中不存在非极性键 | |
| B. | 丙炔分子中3个碳原子都是sp3杂化 | |
| C. | 丙炔分子中所有的原子都在同一直线上 | |
| D. | 丙炔分子中σ键与π键的个数比为3:1 |
8.用以下方法制取氢气,反应速率最小的是( )
| A. | 冬天,块状的锌与2mol/L稀硫酸溶液反应 | |
| B. | 冬天,粉末状的锌与2mol/L稀硫酸溶液反应 | |
| C. | 夏天,块状的锌与2mol/L稀硫酸溶液反应 | |
| D. | 夏天,粉末状的锌与2mol/L稀硫酸溶液反应 |
15.某无色溶液中加入氢氧化铝固体,氢氧化铝迅速溶解,则该溶液中一定能够大量共存的离子组是( )
| A. | K+、Ba2+、NO3-、Cl- | B. | Na+、NH4+、SO42-、HCO3- | ||
| C. | Ca2+、K+、SO32-、NO3- | D. | Na+、K+、Cu2+、Br- |
20.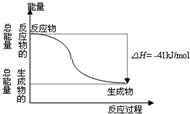 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )| A. | 1mol CO2(g)和1mol H2(g)反应生成1molCO(g)和1mol H2O(g)要放出41kJ热量 | |
| B. | 该反应为放热反应 | |
| C. | 反应的热化学方程式是:CO(g)+H2O (g)=CO2(g)+H2(g)△H=+41kJ/mol | |
| D. | CO(g)与H2O(g)所具有的总能量小于CO2(g)与H2(g)所具有的总能量 |