题目内容
【题目】一定条件下铜与浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,在反应中被氧化与被还原的原子数之比为( )
A. 1∶2 B. 1∶4 C. 1∶1 D. 2∶1
【答案】A
【解析】Cu元素的化合价由0价升至Cu(NO3)2中的+2价,该反应中1molCu被氧化;N元素的化合价由HNO3中的+5价降至NO2中的+4价,该反应中4molHNO3参加反应,只有2molHNO3被还原(还有2molHNO3中N元素的化合价没有变化);被氧化与被还原的原子数之比为1:2,答案选A。

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
【题目】在呼吸面具和潜水艇中可用过氧化钠作供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
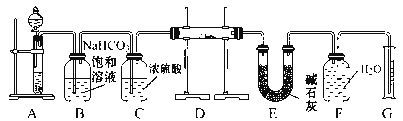
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:____________________。
(2)B、C、E均为除杂装置(U型管中加固体干燥剂)除杂顺序如表:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | 浓硫酸 | _________ |
E | 碱石灰 | _________ |
(3)写出B中发生反应的离子方程式:__________________________________。
(4)写出D中过氧化钠与二氧化碳反应的化学方程式:__________________。
(5)试管F中收集满气体后,证明试管中收集的气体是氧气的实验操作是:_____。