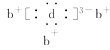题目内容
【题目】现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO![]() 、NO
、NO![]() 的相互分离。相应的实验过程可用下图表示:
的相互分离。相应的实验过程可用下图表示:
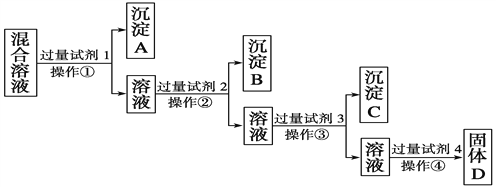
(1)写出上述实验过程中所用试剂的名称:试剂1为______________,试剂2为______________。
(2)控制试剂4的加入量的方法是__________________________。
(3)加入过量试剂3的目的是__________________________________。
(4)操作①的名称是________,在加入试剂4后,获得固体D的实验操作④是______________________(填操作名称)。
(5)写出加入试剂4后发生反应的化学方程式:
__________________________________________________________________。
【答案】 氯化钡溶液(或硝酸钡溶液) 硝酸银溶液 测定溶液的pH 除去溶液中过量的Ba2+、Ag+ 过滤 加热蒸发、冷却结晶、过滤 Na2CO3+2HNO3===2NaNO3+CO2↑+H2O
【解析】本题主要考查物质的分离方法。
(1)上述实验过程中所用试剂的名称:先分离出SO![]() ,试剂1为氯化钡溶液(或硝酸钡溶液),再分离出Cl-,试剂2为硝酸银溶液。
,试剂1为氯化钡溶液(或硝酸钡溶液),再分离出Cl-,试剂2为硝酸银溶液。
(2)试剂4是硝酸溶液,控制试剂4的加入量的方法是测定溶液的pH。
(3)加入过量试剂3的目的是除去溶液中过量的Ba2+、Ag+。
(4)操作①的名称是过滤,在加入试剂4后,获得固体D的实验操作④是加热蒸发、冷却结晶、过滤。
(5)加入试剂4后发生反应的化学方程式:Na2CO3+2HNO3===2NaNO3+CO2↑+H2O。

练习册系列答案
相关题目