题目内容
5.在反应A+B═C+D中,5gA和10gB恰好完全反应,生成8gC;若2.5gA和足量的B反应,可生成D的质量是3.5g.分析 根据质量守恒定律可以计算生成D的质量,在化学反应中,参加反应的A的质量和生成的D的质量对应成比例,据此回答计算.
解答 解:在反应A+B═C+D中,5gA和10gB恰好完全反应,生成8gC,根据质量守恒定律可以计算生成D的质量是5g+10g-8g=7g,若2.5gA和足量的B反应,设可生成D的质量是x,则$\frac{5g}{7g}=\frac{2.5g}{x}$,解得x=3.5g,故答案为:3.5g.
点评 本题考查学生运用质量守恒定律进行数据计算的能力,注意数据之间的关系是关键,难度不大.

练习册系列答案
相关题目
15.已知Na2SO3在空气中易被氧化为Na2SO4,现有一包包装破损的白色Na2SO3固体粉末,为了检验其是否变质,正确的方法是( )
| A. | 取少量样品于试管中,滴入稀盐酸,无沉淀,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| B. | 取少量样品于试管中,滴入稀硝酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| C. | 取少量样品于试管中,滴入稀硫酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| D. | 取少量样品于试管中,滴入稀盐酸,若产生使品红溶液褪色的气体,则说明已变质 |
16.根据中学所学相关知识,下列推断正确的一项是( )
| A. | ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 | |
| B. | 氯气可置换出KBr溶液中的溴,则氟气也可置换出KBr溶液中的溴 | |
| C. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-14+d mol•L-1 | |
| D. | 某温度下,MgCO3的Ksp=6.8×10-6,则该温度下所有含固体MgCO3的溶液,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.8×10-6 |
13.元素X原子最外层上有3个电子,元素Y最外层上有6个电子,由X、Y两种元素形成的化合物的化学式可能为( )
| A. | XY | B. | X2Y3 | C. | XY2 | D. | X2Y |
20.西班牙的瑞奥汀河是一条酸河,河水中含有硫酸和硫酸亚铁.经调查发现,酸河形成的原因是由于上游河床含有的某种物质R在水中氧的作用下发生反应所致,其反应的化学方程式为:2R+2H2O+7O2═2FeSO4+2H2SO4,则R的化学式为( )
| A. | FeS | B. | Fe2S3 | C. | FeS2 | D. | FeO |
17.下列表示的是丙基的是( )
| A. | CH3 CH2CH3 | B. | CH3 CH2CH2- | C. | -CH2CH2CH2- | D. | (CH3 )2CH- |
14.下列金属可用来与稀硫酸反应制备H2的是( )
| A. | Mg | B. | Ag | C. | Cu | D. | Fe |
15.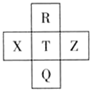 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z>T>X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | R、T、Q的最高正价相同 |