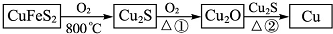题目内容
15.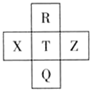 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z>T>X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | R、T、Q的最高正价相同 |
分析 R单质在暗处与H2剧烈化合并发生爆炸,则R为F元素,根据元素在周期表中的位置知,X、T、Z、Q分别是S、Cl、Ar、Br元素,
A.同一周期元素,元素非金属性随着原子序数增大而增强;
B.R原子序数是9,Q原子序数是35;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.R元素非金属性最强,没有正化合价.
解答 解:R单质在暗处与H2剧烈化合并发生爆炸,则R为F元素,根据元素在周期表中的位置知,X、T、Z、Q分别是S、Cl、Ar、Br元素,
A.同一周期元素,元素非金属性随着原子序数增大而增强,所以非金属性T>X,Ar属于稀有气体,性质较稳定,故A错误;
B.R原子序数是9,Q原子序数是35,则R与Q的电子数相差26,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性R>T>Q,所以氢化物的稳定性R>T>Q,故C错误;
D.R元素非金属性最强,没有正化合价,T和Q最高正化合价为+7,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律综合应用,侧重考查学生分析推断能力,明确元素周期表结构、原子结构、元素周期律即可解答,注意F元素没有正化合价,为易错点.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
6.下列关于硅的说法中,不正确的是( )
| A. | 硅是非金属元素,晶体硅是灰黑色有金属光泽的固体 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| D. | 二氧化硅常被用来制造光导纤维 |
10. 丁腈橡胶具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
丁腈橡胶具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN
④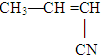 ⑤CH3-CH═CH2 ⑥CH3-CH=CH-CH3.
⑤CH3-CH═CH2 ⑥CH3-CH=CH-CH3.
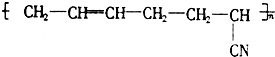 丁腈橡胶具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
丁腈橡胶具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN
④
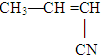 ⑤CH3-CH═CH2 ⑥CH3-CH=CH-CH3.
⑤CH3-CH═CH2 ⑥CH3-CH=CH-CH3.| A. | ③⑥ | B. | ②③ | C. | ①③ | D. | ④⑤ |
20.如图实验装置能达到实验目的是(夹持仪器未画出)( )
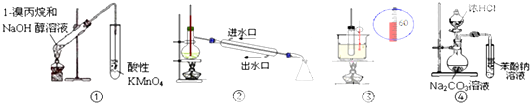

| A. | ①装置用于检验1-溴丙烷消去产物 | B. | ②装置用于石油的分馏 | ||
| C. | ④装置可证明酸性:盐酸>碳酸>苯酚 | D. | ③装置用于实验室制硝基苯 |
7.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S>Se.
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S>Se.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
4.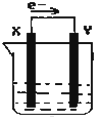 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )| A. | 外电路电流方向为:X→外电路→Y | |
| B. | 若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两极都是金属,则它们的活动顺序为X>Y |
5.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 乙烯能发生加成反应而乙烷不能 | |
| B. | 苯酚(C6H5OH)能跟NaOH溶液反应而乙醇不能 | |
| C. | 甲苯能使KMnO4酸性溶液褪色而乙烷不能 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |