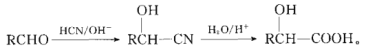题目内容
【题目】无水氯化铜是铜(II)的氯化物,化学式为CuCl2,棕黄色固体,吸收水分后变为蓝绿色的二水合物,实验室用如下装置制备少量无水氯化铜。完成下列填空:
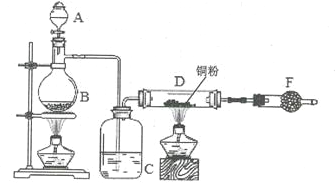
(1)写出烧瓶中(B处)发生反应的化学方程式:____。
(2)c中盛有的试剂为__________,进行实验时应先点燃__(选填“B”或“D”)处酒精灯。
(3)F中盛有碱石灰,其目的是____(选填序号)。
a.吸收HCl b.吸收Cl2c.吸收CO2d.吸收H2SO4
(4)将D中固体改为市售氯化铜(CuCl2.2H2O,Mr=171),也能进行无水氯化铜的制备,此时向D中通入HC1气体,目的是___。若实验条件控制不当,最终得到的物质是碱式氯化铜[化学式为Cu4(OH)nCl(8-n)],且质量是原市售氯化铜的62.7%,则可推算n的值为___(整数值)。
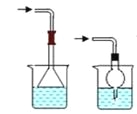
(5)有同学提出将上述装置F(干燥管)改为碱液来处理尾气,请在方框内画出尾气处理装置图__________。
【答案】MnO2+ 4 HCl(浓)![]() MnCl2+ Cl2↑ + 2 H2O 浓硫酸 B ab 抑制CuCl2水解 6 烧杯中盛装氢氧化钠等碱性溶液(装置如右图所示),
MnCl2+ Cl2↑ + 2 H2O 浓硫酸 B ab 抑制CuCl2水解 6 烧杯中盛装氢氧化钠等碱性溶液(装置如右图所示), 其他合理答案
其他合理答案
【解析】
(1)B装置制取氯气,用MnO2和浓盐酸反应,MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)信息制取无水氯化铜,氯化铜吸水后变成蓝绿色二水合物,制出的氯气含有水蒸气,影响氯化铜的制取,因此必须除去,因此C装置中盛放浓硫酸,装置中有空气,点燃铜时,铜容易和氧气反应生成氧化铜,因此先通一段时间的氯气,排除装置的空气;
MnCl2+Cl2↑+2H2O;(2)信息制取无水氯化铜,氯化铜吸水后变成蓝绿色二水合物,制出的氯气含有水蒸气,影响氯化铜的制取,因此必须除去,因此C装置中盛放浓硫酸,装置中有空气,点燃铜时,铜容易和氧气反应生成氧化铜,因此先通一段时间的氯气,排除装置的空气;
(3)氯气有毒,同时制出的氯气中含有氯化氢,为防止污染空气,必须除去,因此碱石灰的作用是a、b;
(4)CuCl2中Cu2++2H2O![]() Cu(OH)2+2H+,通HCl的目的是抑制氯化铜的水解,假设有1mol碱式氯化铜,则碱式氯化铜的质量为(540-18.5n)g,根据铜原子守恒,则市售氯化铜的质量为4×171g,则有(540-18.5n)/4×171×100%=62.7%,解得n=6;
Cu(OH)2+2H+,通HCl的目的是抑制氯化铜的水解,假设有1mol碱式氯化铜,则碱式氯化铜的质量为(540-18.5n)g,根据铜原子守恒,则市售氯化铜的质量为4×171g,则有(540-18.5n)/4×171×100%=62.7%,解得n=6;
(5)氯气用碱液吸收,防止倒吸,采用倒置的漏斗或干燥管,因此装置图:
 。
。

【题目】现有部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第________周期______族;
(2)元素Y的原子结构示意图为________。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应