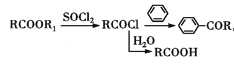
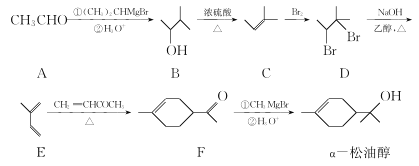
题目内容
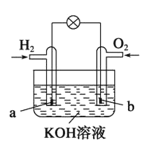
【题目】图中甲池的总反应式为![]() 。
。
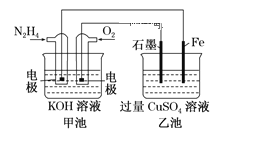
(1)甲池中负极上的电极反应式为_____________________。
(2)乙池中石墨电极上电极反应式为_________________________________。
(3)要使乙池恢复到电解前的状态,应向溶液中加入适量的 _______________。
A.CuO B.Cu(OH)2 C.CuCO3 D.CuSO4
(4)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为_________________g。
【答案】N2H4+4OH--4e-=N2↑+4H2O 2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑ A、C 12.8
【解析】
从图中可以看出,甲池为燃料电池,乙池为电解池。通N2H4的电极为负极,通O2的电极为正极;乙池中,石墨电极为阳极,铁电极为阴极。
(1)甲池中通入N2H4的电极为负极,N2H4在碱性条件下失电子,生成N2等。
(2)乙池中石墨电极为阳极,H2O失电子,生成O2等。
(3)要使乙池恢复到电解前的状态,应先看阴、阳极的产物,离开溶液的两电极产物反应后,加入电解后的乙池电解质溶液中,即可恢复原来的性质。
(4)乙池电极得失电子的物质的量,与N2H4失电子的物质的量相等,当甲中消耗1.6gN2H4时,线路中通过的电子为![]() =0.2mol,即可求出乙池中两个电极质量差。
=0.2mol,即可求出乙池中两个电极质量差。
(1)甲池中通入N2H4的电极为负极,N2H4在碱性条件下失电子,生成N2等,电极反应式为N2H4+4OH--4e-=N2↑+4H2O。答案为:N2H4+4OH--4e-=N2↑+4H2O;
(2)乙池中石墨电极为阳极,H2O失电子,生成O2等,电极反应式为2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑。答案为:2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑;
(3)乙池中石墨电极反应式为2H2O-4e-=O2↑+4H+,铁电极反应式为Cu2++2e-=Cu,O2与Cu反应生成CuO,所以应往溶液中加入CuO或CuOCO2。答案为:A、C;
(4)在乙池中,石墨电极换为铜电极,电极反应式为Cu-2e-=Cu2+,铁电极不变,铁电极发生的反应式为Cu2++2e-=Cu。当甲中消耗1.6gN2H4时,线路中通过的电子为![]() =0.2mol,即可求出乙池中,铜电极质量减轻0.1mol×64g/mol=6.4g,Fe电极质量增重0.1mol×64g/mol=6.4g,两个电极质量差为6.4g-(-6.4g)=12.8g。答案为:12.8。
=0.2mol,即可求出乙池中,铜电极质量减轻0.1mol×64g/mol=6.4g,Fe电极质量增重0.1mol×64g/mol=6.4g,两个电极质量差为6.4g-(-6.4g)=12.8g。答案为:12.8。

【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D