题目内容
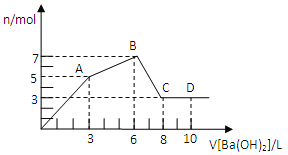
【题目】下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是
①CH2O、C2H4O2、C6H1206
②H2、CO、CH3OH
③CH2=CH2、C2H5OH、HOCH2CH2COOH
④C6H6、 C5H10、C7H6O2
A.③④B.①②C.①④D.②③
【答案】A
【解析】
碳、氢元素完全燃烧分别生成二氧化碳、水。将各物质组成通式写成CxHyOz,各物质的的![]() 值相等,则符合题意。①CH2O、C2H4O2、C6H12O6 的
值相等,则符合题意。①CH2O、C2H4O2、C6H12O6 的![]() 值分别为(1+0.5-0.5)=1、(2+1-1)=2、(6+3-3)=6,不符合;②H2、CO、CH3OH的
值分别为(1+0.5-0.5)=1、(2+1-1)=2、(6+3-3)=6,不符合;②H2、CO、CH3OH的![]() 值分别为0.5、(1-0.5)=0.5、(1+1-0.5)=1.5,不符合;③CH2=CH2、C2H5OH、HOCH2CH2COOH的
值分别为0.5、(1-0.5)=0.5、(1+1-0.5)=1.5,不符合;③CH2=CH2、C2H5OH、HOCH2CH2COOH的![]() 值分别为(2+1)=3、(2+1.5-0.5)=3、(3+1.5-1.5)=3,值相同,符合;④C6H6、 C5H10、C7H6O2的
值分别为(2+1)=3、(2+1.5-0.5)=3、(3+1.5-1.5)=3,值相同,符合;④C6H6、 C5H10、C7H6O2的![]() 值分别为(6+1.5)=7.5、(5+2.5)=7.5、(7+1.5-1)=7.5,值相同,符合;
值分别为(6+1.5)=7.5、(5+2.5)=7.5、(7+1.5-1)=7.5,值相同,符合;
答案选A。

【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的 NO,进行反应C(s)+2NO(g) ![]() N2(g)+CO2(g),测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
N2(g)+CO2(g),测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
容器(温度) | 0min | 40min | 80min | 120min | 160min | |
甲(400℃) | c(NO) | 2.00 mol/ L | 1.50 mol/ L | 1.10 mol/ L | 0.80 mol/ L | 0.80 mol/ L |
乙(400℃) | c(NO) | 1.00 mol/ L | 0.80 mol/ L | 0.65 mol/ L | 0.53 mol/ L | 0.45 mol/ L |
丙(T℃) | c(NO) | 2.00 mol/ L | 1.40 mol/ L | 1.10 mol/ L | 1.10 mol/ L | 1.10 mol/ L |
A.达到平衡状态时,2v正(NO)= v逆(N2)
B.活性炭的质量不再改变不能说明反应已达平衡状态
C.丙容器中,从反应开始到建立平衡时的平均反应速率为v(NO) >0.01125 mol·L-1·min-1
D.由表格数据可知:T<400℃
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
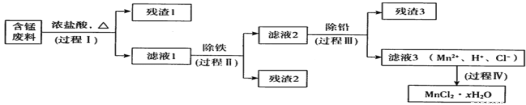
资料a:Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-l
(1)过程I的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是____________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:分别取两份少量滤液1于试管中,一份__________;另一份 ________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a. 2Fe2++Cl2= 2Fe3++2Cl- b.4Fe2++O2+4H+=4Fe3++2H2O
c.…… 写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ii.焙烧法:将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物加水溶解、过滤,滤液再加盐酸酸化至合适pH。
已知:焙烧中发生的主要反应为2FeCl3+3O2![]() 2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化。
2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在__________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,固体质量减轻m2g。则x=________。