题目内容
【题目】(1)已知:①N2(g)+O2(g)=2NO(g) ΔH=180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ· mol-1
③2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ· mol-1
若某反应Ⅰ的平衡常数表达式为K=![]() 请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
(2)一定温度下,向体积为V L的密闭容器中充入一定量的NO和CO,发生反应Ⅰ。
①下列说法正确的是____。
A 当容器内气体压强不再发生变化时,说明反应已达到平衡状态
B 当v(CO2)=v(CO)时,说明反应已达到平衡状态
C 达到平衡后,若向容器中再充入一定量NO,则NO转化率将减小
D 达到平衡后,若再升高温度,由于逆反应速率增大,正反应速率减小,因此平衡向逆反应方向移动
②若反应在t1时刻达到平衡状态,在其他条件不变的情况下,t2时刻通过缩小容器体积使压强增大到原来的2倍,t3时刻达到新的平衡状态。请在图中补充画出t2~t4时段c(NO)的变化曲线: ____

(3)分离高炉煤气得到的CO与空气可设计成燃料电池而除去(以KOH溶液为电解质溶液)。写出该电池的负极反应式:_____________。
【答案】2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH=-746.5 kJ· mol-1 低温 AC
N2(g)+2CO2(g) ΔH=-746.5 kJ· mol-1 低温 AC 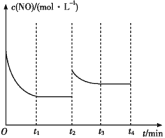 CO+4OH--2e-= CO32-+2H2O
CO+4OH--2e-= CO32-+2H2O
【解析】
(1)根据平衡常数的表达式可知方程式为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),ΔH=②×2-①-③=-746.5 kJ·mol-1。此反应的ΔH<0,ΔS<0,故低温条件下可自发进行;
N2(g)+2CO2(g),ΔH=②×2-①-③=-746.5 kJ·mol-1。此反应的ΔH<0,ΔS<0,故低温条件下可自发进行;
(2)①A.恒温恒容下,压强和混合气的总的物质的量成正比,压强不变说明混合气体的总物质的量不变。该反应是反应前后气体系数之和不相等的反应,故压强不变可以说明反应已经平衡,A正确;
B.没有说明正逆情况,无法判断,B错误;
C.增大NO的浓度,会使CO的转化率增大,而NO的转化率会降低,故C正确;
D.升温正、逆反应速率都增大,D错误。
故选AC。
②t2瞬间体积加倍,c(NO)为原平衡时的2倍,由于平衡向正向移动,所以c(NO)再慢慢降低,当t3达到新平衡时c(NO)介于1倍和2倍原浓度之间,之后t3~t4 c(NO)不变。故答案为: ;
;
(3)负极失电子,元素化合价升高,故反应物为CO,在碱性的KOH溶液生成物为CO32-,根据电荷守恒和质量守恒补充H2O和OH-到方程式中配平,得到电极反应式为:CO+4OH--2e-= CO32-+2H2O。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案