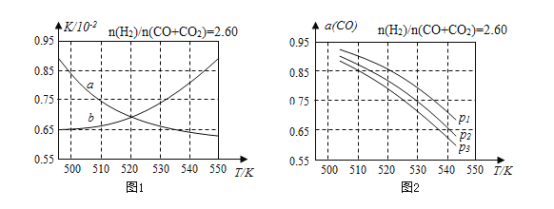
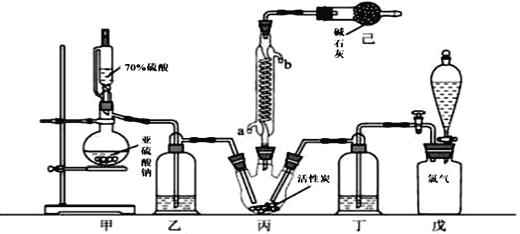
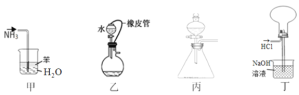
题目内容
【题目】日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2![]() +2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是
+2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是
A.干电池工作时,电子流动方向是由锌筒经外电路流向石墨棒
B.干电池中锌筒为负极,石墨棒为正极
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.干电池可实现化学能向电能和电能向化学能的相互转化
【答案】D
【解析】
由干电池的电极反应,可确定锌筒为负极,石墨棒为正极。
A.干电池工作时,电子流动方向是由负极(锌筒)经外电路流向正极(石墨棒),A正确;
B.由分析知,干电池中锌筒失电子作负极,石墨棒得电子作正极,B正确;
C.外电路中每通过0.2mol电子,锌失电子的物质的量为0.1mol,质量理论上减小0.1mol×65g/mol=6.5g,C正确;
D.干电池为一次电池,不能实现电能向化学能的转化,D不正确;
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化)。下列各组物质中,不能满足此转化关系的是( )
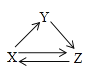
物质 选项 | X | Y | Z |
A | Al | Al2O3 | NaAlO2 |
B | Fe | FeCl3 | FeCl2 |
C | C | CO | CO2 |
D | Cl2 | HCl | NaCl |
A. A B. B C. C D. D