题目内容
【题目】无水FeCl3呈棕红色,极易潮解, 100 ℃ 左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
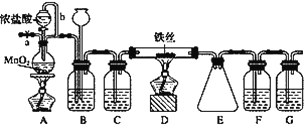
(1)装置A中反应的离子方程式为____________________________________________。
(2)装置F中所加的试剂为________。
(3)导管b的作用为________________________________________________________;
装置B的作用为__________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为______________________________。
(5)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入____________, ___________(填试剂名称和现象)。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 浓硫酸(或浓H2SO4) 平衡压强(或使浓盐酸顺利流下) 除去Cl2中的HCl气体,判断实验过程中导管是否被产品堵塞 排尽实验装置中的空气 KSCN溶液 溶液变红
Mn2++Cl2↑+2H2O 浓硫酸(或浓H2SO4) 平衡压强(或使浓盐酸顺利流下) 除去Cl2中的HCl气体,判断实验过程中导管是否被产品堵塞 排尽实验装置中的空气 KSCN溶液 溶液变红
【解析】
根据实验装置图可知,用浓盐酸与二氧化锰反应生成氯气,氯气中有氯化氢和水杂质,为制备并收集无水FeCl3,B装置中装饱和食盐水,除去氯气中的氯化氢,通过装置中的长颈漏斗可判断实验过程中导管是否被产品堵塞,C装置中装浓硫酸干燥氯气,D装置中铁与氯气反应生成氯化铁,E装置收集生成的氯化铁,实验尾气中有氯气,要用氢氧化钠溶液吸收,由于无水FeCl3极易潮解,所以在收集装置和尾气吸收装置之间加一个干燥装置,防止吸收装置中的水份与氯化铁反应,所以F中装浓硫酸,G中装氢氧化钠溶液,实验时由于装置中有空气中的水蒸气,会与氯化铁反应,所以要先排除装置中的空气,据此答题。
(1)加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应的化学方程式为4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑,故离子方程式为MnO2+4H++2Cl-
MnCl2+2H2O+Cl2↑,故离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)根据上面的分析可知,FeCl3极易潮解,气体必须干燥,装置F中所加的试剂为浓硫酸或浓H2SO4。
(3)根据装置图可知,导管b的作用为平衡压强(或使浓盐酸顺利流下),装置B的作用为除去Cl2中的HCl气体,通过装置中的长颈漏斗可判断实验过程中导管是否被产品堵塞,即装置B的作用为除去Cl2中的HCl气体,判断实验过程中导管是否被产品堵塞;
(4)根据上面的分析可知,若先点燃D处酒精灯,铁丝会与装置中的空气反应,实验时应先排尽实验装置中的空气,所以实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯;
(5)为检验所得产品中是否含有FeCl3,可使用KSCN溶液,当溶液变红可证明产品中含有FeCl3,即试剂名称和现象分别是KSCN溶液、溶液变红。