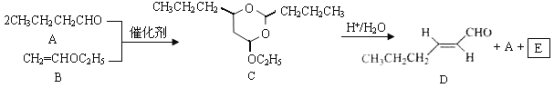
题目内容
【题目】下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,用相应的化学用语回答下列问题;
① | |||||||
② | ③ | ④ | ⑤ | ||||
⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中用序号标出的10种元素中,非金属性最强元素的离子结构示意图是____________。
(2)④、⑦、⑩的离子半径由大到小的顺序为____________(用元素符号作答)。
(3)由表中④、⑥元素可以组成一种淡黄色的物质,画出该物质的电子式____________,该物质含有的化学键类型有____________。
(4)元素②的简单气态氢化物为X,0.1molX完成燃烧生成稳定氧化物时放出akJ的能量,写出X燃烧热的热化学方程式:____________。
(5)写出实验室制备氨气的反应方程式____________。
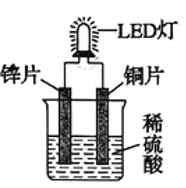
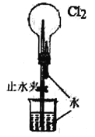
(6)一种氢气燃料电池的原理如图:
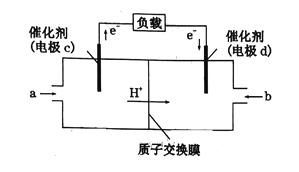
a极通入的气体是____________,正极的电极反应式为____________。
【答案】![]() Cl>O>Al
Cl>O>Al ![]() 非极性共价键和离子键 CH4(g)+2O2(g)→CO2(g)+2H2O(l)
非极性共价键和离子键 CH4(g)+2O2(g)→CO2(g)+2H2O(l) ![]() Ca(OH)2+2NH4Cl
Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O H2 O2+4H++4e-=2H2O
CaCl2+2NH3↑+2H2O H2 O2+4H++4e-=2H2O
【解析】
结合元素在周期表中的位置可知,①②③④⑤⑥⑦⑧⑨⑩分别为:H、C、N、O、F、Na、Al、P、S、Cl,据此解答。
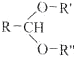
(1)同周期从左往右,非金属性增强,同主族从上往下,非金属性减弱,则所标出元素中,非金属性最强的元素为F,其离子结构示意图![]() ,故答案为:
,故答案为:![]() ;
;
(2)④、⑦、⑩的离子分别为O2-、Al3+、Cl-,O2-、Al3+核外有2个电子层,Cl-核外有3个电子层,Cl-的半径最大,O2-、Al3+核外均有2个电子层,O2-的核电荷数较小,半径比Al3+大,所以三种离子半径由大到小的顺序为:Cl->O2->Al3+,故答案为:Cl>O>Al;
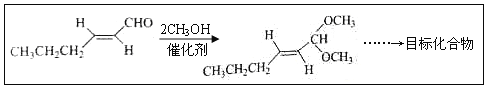
(3)淡黄色物质为Na2O2,Na2O2是含有非极性共价键的离子化合物,其电子式为:![]() ,含有非极性共价键和离子键,故答案为:
,含有非极性共价键和离子键,故答案为:![]() ;非极性共价键和离子键;
;非极性共价键和离子键;
(4)元素②为C,其简单气态氢化物为X(CH4),0.1molCH4完成燃烧生成稳定氧化物时放出akJ的能量,则1molCH4完成燃烧生成稳定氧化物时放出10akJ的能量,所以,X(CH4)燃烧热的热化学方程式为CH4(g)+2O2(g)→CO2(g)+2H2O(l) ![]() ,故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)
,故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l) ![]() ;
;
(5)实验室常用共热Ca(OH)2固体和NH4Cl固体的方法制备氨气,反应的化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(6)电子流向为:负极→负载→正极,所以a极为负极,H2在负极失电子变为H+,所以a极通入的是H2,b极为正极,O2在正极得电子,发生的电极反应为:O2+4H++4e-=2H2O,故答案为:H2;O2+4H++4e-=2H2O。

 阅读快车系列答案
阅读快车系列答案