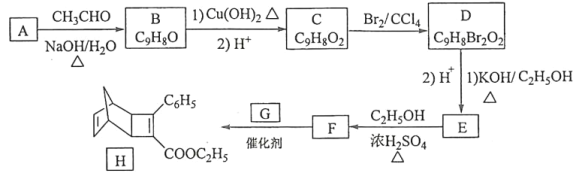
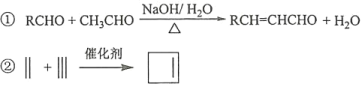
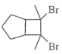
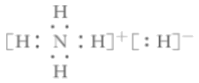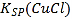题目内容
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)与O2(g)反应生成NO(g)过程中的能量变化:
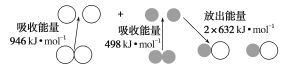
下列说法中正确的是( )
A.1 mol N2(g)与1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)与O2(g)混合能直接生成NO(g)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
【答案】B
【解析】
焓变=反应物键能之和-生成物键能之和,所以N2(g)+O2(g)=2NO(g) △H=946 kJ/mol+498 kJ/mol-2×632 kJ/mol=+180 kJ/mol>0,所以该反应为吸热反应。
A.根据分析可知该1mol N2(g)与1 mol O2(g)反应为吸热反应,A说法错误;
B.1mol N2(g)和1mol O2(g)反应为吸热反应,所以反应物具有的总能量小于生成物具有的总能量,B说法正确;
C.在放电条件下,N2(g)与O2(g)混合能直接生成NO(g),通常情况下二者不反应,C说法错误;
D.NO不是酸性氧化物,与NaOH溶液不反应,D说法错误;
答案为B。

 名校课堂系列答案
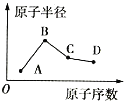
名校课堂系列答案【题目】下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,用相应的化学用语回答下列问题;
① | |||||||
② | ③ | ④ | ⑤ | ||||
⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中用序号标出的10种元素中,非金属性最强元素的离子结构示意图是____________。
(2)④、⑦、⑩的离子半径由大到小的顺序为____________(用元素符号作答)。
(3)由表中④、⑥元素可以组成一种淡黄色的物质,画出该物质的电子式____________,该物质含有的化学键类型有____________。
(4)元素②的简单气态氢化物为X,0.1molX完成燃烧生成稳定氧化物时放出akJ的能量,写出X燃烧热的热化学方程式:____________。
(5)写出实验室制备氨气的反应方程式____________。
(6)一种氢气燃料电池的原理如图:
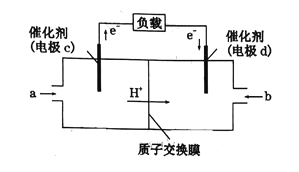
a极通入的气体是____________,正极的电极反应式为____________。