题目内容
【题目】已知A、F为金属单质,C是淡黄色粉末,回答下题。
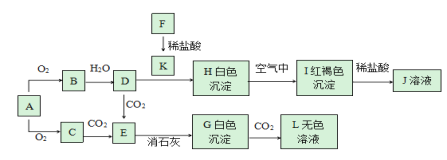
(1)实验室中A常常保存在__中,若将0.1molC直接转化成D,转移电子数为__个。
(2)写出D与J混合的离子反应方程式__。
(3)用化学方程式表示沉淀H转化成I颜色发生变化的原因:__。
(4)直接向K溶液中加入C固体,写出可能出现的现象:__。
(5)向盛有L溶液的水槽中加入一小块金属A,下列现象描述不符合实际情况的是__。
a.金属A浮在液面,并四处游动
b.金属A会熔化成一个小球
c.反应开始后,溶液由无色变成红色
d.恢复到室温时,烧杯底部有固体物质析出
(6)0.12molFeCl2加入100mLK2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-被还原为Cr3+。则K2Cr2O7溶液的物质的量浓度为__。
【答案】煤油 0.1NA(或6.02×1022) Fe3++3OH-=Fe(OH)3↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 有无色气体生成,产生红褐色沉淀 c 0.2mol·L-1
【解析】
A为金属单质,A与氧气反应生成的C是淡黄色粉末,则A为Na,C为Na2O2。由转化关系可知B是Na2O、D是NaOH、E是Na2CO3、G是CaCO3、L是Ca(HCO3)2。金属F与盐酸反应生成K,而K能与NaOH反应生成白色沉淀H,H在空气中可以转化为红褐色沉淀I,则F为Fe、K为FeCl2、H为Fe(OH)2、I为Fe(OH)3、J为FeCl3;Fe2+转化为Fe3+,Cr2O72-被还原为Cr3+,根据电子守恒列式计算。
(1)实验室中Na常常保存在煤油中。C转变成D的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠既是氧化剂又是还原剂,各占一半,0.1mol 过氧化钠参与该反应,转移电子的个数为:0.1mol×1/2×2×6.02×1023 mol-1=6.02×1022;
(2)D与J混合的离子反应方程式为:Fe3++3OH-=Fe(OH)3↓;
(3)用化学方程式表示沉淀H转化成I颜色发生变化的原因:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)直接向FeCl2溶液中加入Na2O2固体,过氧化钠能与水反应生成氢氧化钠与氧气,过氧化钠具有强氧化性,会得到Fe(OH)3,可能出现的现象:有无色气体生成,产生红褐色沉淀;
(5)向盛有Ca(HCO3)2溶液的水槽中加入一小块金属Na,Na与水反应生成NaOH与氢气,NaOH再与Ca(HCO3)2反应生成CaCO3,可以看到的现象:金属Na浮在液面,熔化成一个小球,发出嘶嘶声响,并四处游动,最后消失,恢复到室温时烧杯底白色沉淀,故答案为c;
(6)FeCl2失去电子的物质的量为:0.12mol×(3-2)=0.12mol,设K2Cr2O7溶液的物质的量浓度为cmol/L,K2Cr2O7得电子的物质的量为:0.1L×2×(6-3)cmol/L=0.6cmol,根据得失电子守恒可知:0.6cmol=0.12mol,解得:c=0.2mol/L。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D