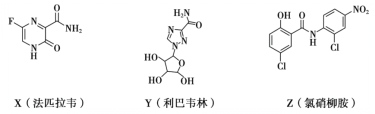
题目内容
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。下列研究目的和图示相符的是
2NH3(g) ΔH<0。下列研究目的和图示相符的是
A | B | C | D | |
研究目的 | 温度(T)对反应的影响(T2>T1) | 压强(p)对平衡常数的影响 | 温度(T)对反应的影响 | 压强(p)对反应的影响(p2>p1) |
图示 |
|
|
|
|
A.AB.B .C.CD.D
【答案】C
【解析】
A、温度越高反应速率越快,则温度T2对应曲线斜率大,A错误;
B、平衡常数只受温度的影响,所以压强增大时,平衡常数不变,B错误;
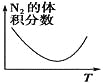
C、在建立平衡的过程中,反应要正向进行,氮气体积分数变小,当达到平衡后,由于该反应为放热反应,所以升高温度,平衡逆向移动,氮气体积分数变大,C正确;
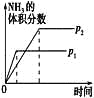
D、由于该反应是气体体积减小的反应,增大压强,平衡向正反应方向移动,氨气的体积分数变大,即压强越大,氨气的体积分数越大,且首先达到平衡状态,D错误;
答案选C。
【点晴】
本题解题的关键在于对图象的识别,有关化学平衡图像题的解答思路可以归纳为
 ,然后再结合反应的特点分析判断即可。
,然后再结合反应的特点分析判断即可。

练习册系列答案
相关题目