题目内容
【题目】下列各组离子在指定的溶液中能大量共存的是
A. 常温下,水电离的c(OH-)=1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 常温下,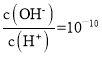 的溶液中:K+、Na+、I-、SO42-
的溶液中:K+、Na+、I-、SO42-
C. 能使酚酞变红的溶液中:Na+、Ba2+、HSO3-、Cl-
D. 0.1 mol·L1 KI溶液:Na+、K+、ClO、OH
【答案】B
【解析】
A. 常温下,水电离的c(OH-)=1×10-12mo1·L-1的溶液中,水的电离被抑制,故溶液为酸溶液或碱溶液,在酸性条件下,硝酸根具有强氧化性,与亚铁离子无法大量共存,在碱性条件下,无法大量存在铵根离子和亚铁离子,故A错误;
B. 常温下,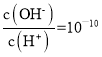 的溶液显酸性,K+、Na+、I-、SO42-可以大量共存,B正确;
的溶液显酸性,K+、Na+、I-、SO42-可以大量共存,B正确;
C. 能使酚酞变红的溶液显碱性,存在大量氢氧根离子,无法与HSO3-共存,C错误;
D. I-具有强还原性,ClO具有强氧化性,无法大量共存,D错误;
故答案选B。

【题目】碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为________,可能发生副反应有_______。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为___________。
(3)向75 mL 4 molL-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。
①写出该反应的离子方程式:___________________________。
②该吸收溶液中离子浓度大小排序为_________________________。
③常温下,a molL-1KHCO3溶液的pH=8,HCO3的水解常数约等于__________。(用含a式表示)。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1= —571.6kJmol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJmol-1
③ CO(g)+2H2(g)![]() CH3OH(g) △H3 = —90.8kJmol-1
CH3OH(g) △H3 = —90.8kJmol-1
计算甲醇蒸气的燃烧热△H=_______________。
(5)某温度下,发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
0 | 5 min | 10 min | 15 min | 20 min | 25 min | |
I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验I,实验II可能改变的条件可能是________,该温度下,平衡常数=_______。