题目内容
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减 小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母)
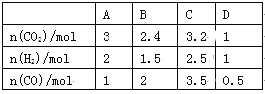
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
【答案】
(1)放热
(2)增大 、增大
(3)AC
(4)24%
【解析】
试题分析:(1)根据表中数据可知升高温度平衡常数减小,这说明升高温度平衡向逆反应方向进行,因此上述反应的正反应是放热反应。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率增大。由于反应前后体积不变,则根据PV=nRT可知容器内混合气体的压强增大。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,由于反应前后体积不变,则用物质的量表示浓度计算浓度熵,即此时浓度熵分别是![]() =1.2、
=1.2、![]() =0.9、
=0.9、![]() 、
、![]() =1,所以向逆反应方向进行的有A、C。
=1,所以向逆反应方向进行的有A、C。
(4) CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 2 3 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 2-x 3-x x x
则![]()
解得x=1.2
所以H2(g)的体积分数=![]() =24%。
=24%。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案