题目内容
【题目】为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1
N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1
(1)若用4.48 L CH4还原NO生成N2,则放出的热量为 kJ(保留两位小数)。(气体体积已折算为标准状况下)
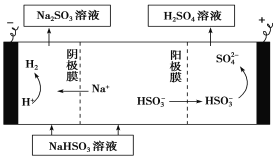
(2)用电化学处理含NO3—的废水,电解的原理如图1所示,则电解时阴极的电极反应式为 ;
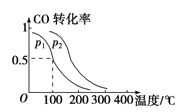
Ⅱ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(3)T1时,该反应的化学平衡常数的数值为 。
(4)下列说法不正确的是 (填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
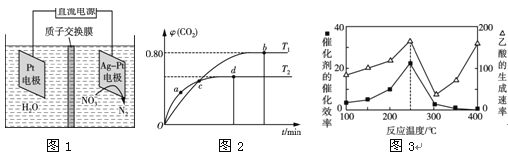
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)![]() CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(5)250~300 ℃时,乙酸的生成速率减小的主要原因是 。
【答案】
(1)119.88
(2)2NO3—+12H++10e-=N2↑+6H2O
(3)1024
(4)BD
(5)温度超过250 ℃时,催化剂的催化效率降低
【解析】
试题分析:(1)已知①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1[来
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1[来
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1
N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1
根据盖斯定律可知②×2—①即可得到CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=—599.4kJ/mol。4.48LCH4的物质的量是0.2mol,所以还原NO生成N2放出的热量为599.4kJ/mol×0.2mol=119.88kJ。
(2)电解时阴极得到电子,发生还原反应,则根据示意图可知硝酸根得到电子转化为氮气,电极反应式为2NO3—+12H++10e-=N2↑+6H2O。
(3)根据图像可知T1时,CO2的体积分数是0.8,则CO2是0.8×5mol=4mol,CO是1mol,所以根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知该反应的化学平衡常数的数值为![]() 。
。
(4)A.密度是混合气的质量和容器容积的比值,在反应过程中体积不变,但气体的质量变化,所以容器内气体密度不变,表明反应达到平衡状态,A正确;B.两种温度下,c点时体系中温度不同,所以混合气体的压强不相等,B错误;C.d点时,在原容器中充入一定量氦气,浓度不变,平衡不移动,所以CO的转化率不变,C正确;D.T2曲线首先平衡,说明温度是T2大于 T1。温度高CO2的含量降低,说明升高温度平衡向逆反应方向进行,则平衡常数减小,所以b点和d点时化学平衡常数的大小关系:Kb>Kd,D错误,答案选BD。
(5)根据图像可知250—300℃时,乙酸的生成速率减小的主要原因是250℃~300℃时,催化剂的催化效率降低。