题目内容
5.将5.32g纯Fe溶于足量稀H2SO4中,在加热条件下用2.53gKNO3去氧化溶液中的Fe2+,充分反应后余下的Fe2+还原0.009mol Cl2才能完全氧化,则KNO3的还原产物中N的化合价是( )| A. | -3 | B. | +4 | C. | +3 | D. | +2 |
分析 Fe与稀硫酸反应生成硫酸亚铁,n(Fe)=n(Fe2+)=$\frac{5.32g}{56g/mol}$=0.095mol,在加热条件下用2.53gKNO3去氧化溶液中的Fe2+,充分反应后余下的Fe2+还原0.009mol Cl2才能完全氧化,则亚铁离子的失去电子数等于N、Cl得到电子数之和,以此来解答.
解答 解:Fe与稀硫酸反应生成硫酸亚铁,n(Fe)=n(Fe2+)=$\frac{5.32g}{56g/mol}$=0.095mol,
设KNO3的还原产物中N的化合价为x,
由电子守恒可知,0.095mol×(3-2)=$\frac{2.53g}{101g/mol}$×(5-x)+0.009mol×2×(1-0),
解得x=+2,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
15.已知可逆反应a A(g)+b B(?)?c C(g)△H>0(B物质的状态未确定).关于该反应的描述正确的是( )
| A. | 加压若平衡正向移动,则a>c | |
| B. | 加入一定量的B,平衡一定正向移动 | |
| C. | 缩小容器的体积,各物质的浓度一定增大 | |
| D. | 升高温度,平衡一定正向移动,混合气体的平均摩尔质量的变化不能确定 |
13.用ωg氢氧化钠配制一定浓度的溶液来滴定盐酸,若氢氧化钠中混有碳酸钠,则测得盐酸的浓度是( )
| A. | 偏高 | B. | 偏低 | C. | 不变 | D. | 无法判断 |
1.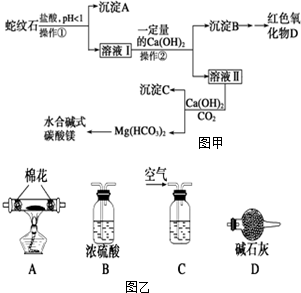 蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
实验步骤如图甲,请回答下列问题:
(1)实验室完成操作①所用到的玻璃仪器有玻璃棒、漏斗、烧杯.
(2)检验溶液Ⅱ中是否含有Fe3+的操作与结论是取少量溶液Ⅱ于试管中,加入KSCN溶液,若无明显现象,说明溶液Ⅱ不含Fe3+;若溶液变红色,说明溶液Ⅱ含有Fe3+
(3)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为OH-+Al(OH)3═AlO2-+2H2O,再进行过滤、洗涤、加热(依次填写实验操作名称).
(4)操作②中应控制溶液pH的合理范围是C(填序号).
A.小于1.5 B.1.5~3.3 C.7~8 D.大于9.4
(5)为探究所得的水合碱式碳酸镁[xMgCO3•yMg(OH)2•zH2O]的组成,取样7.28g于装置A的玻璃管中,请按由左-→右顺序将如图乙装置连接好(填序号,装置可重复使用)C-→B-→A-→B-→D-→B(或D),装置C应盛的试剂是氢氧化钠溶液.充分反应后,如果实验测得硬质玻璃管中剩余固体3.2g,共放出2.64g CO2气体,则x:y:z=3:1:3.
 蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(1)实验室完成操作①所用到的玻璃仪器有玻璃棒、漏斗、烧杯.
(2)检验溶液Ⅱ中是否含有Fe3+的操作与结论是取少量溶液Ⅱ于试管中,加入KSCN溶液,若无明显现象,说明溶液Ⅱ不含Fe3+;若溶液变红色,说明溶液Ⅱ含有Fe3+
(3)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为OH-+Al(OH)3═AlO2-+2H2O,再进行过滤、洗涤、加热(依次填写实验操作名称).
(4)操作②中应控制溶液pH的合理范围是C(填序号).
A.小于1.5 B.1.5~3.3 C.7~8 D.大于9.4
(5)为探究所得的水合碱式碳酸镁[xMgCO3•yMg(OH)2•zH2O]的组成,取样7.28g于装置A的玻璃管中,请按由左-→右顺序将如图乙装置连接好(填序号,装置可重复使用)C-→B-→A-→B-→D-→B(或D),装置C应盛的试剂是氢氧化钠溶液.充分反应后,如果实验测得硬质玻璃管中剩余固体3.2g,共放出2.64g CO2气体,则x:y:z=3:1:3.
3.某课外小组探究钠、铝、铁、铜单质还原性强弱及其相关化学性质,做了如表实验:
(1)实验1中能发生反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是铝、铁均产生气泡且铝稍快些,铜不产生气泡.
结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;请从原子结构角度解释钠的还原性强于铝Na、Al同属于第三周期Na原子半径大于Al.
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液逐滴加入过量的NaOH溶液
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是bc.
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗.
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置.
①画出原电池的装置图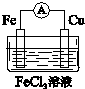 .
.
②该电池的正极反应为2Fe3++2e-=2Fe2+.
| 实验1 | 常温时取四种金属少量分别放入装有蒸馏水的试管中 |
| 实验2 | 再取少量铝、铁、铜分别放入装有稀硫酸的试管中 |
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是铝、铁均产生气泡且铝稍快些,铜不产生气泡.
结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;请从原子结构角度解释钠的还原性强于铝Na、Al同属于第三周期Na原子半径大于Al.
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液逐滴加入过量的NaOH溶液
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是bc.
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗.
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置.
①画出原电池的装置图
 .
.②该电池的正极反应为2Fe3++2e-=2Fe2+.

 如图,一密闭气缸被一不漏气可滑动的活塞隔成两部分,左室充有氮气,右室充有混合气体.在室温下将右室的气体点燃,反应后冷却至原室温,活塞最终静止于气缸的某一点(液体体积忽略不计).
如图,一密闭气缸被一不漏气可滑动的活塞隔成两部分,左室充有氮气,右室充有混合气体.在室温下将右室的气体点燃,反应后冷却至原室温,活塞最终静止于气缸的某一点(液体体积忽略不计).