题目内容
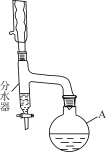
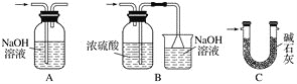
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
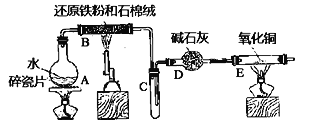
回答下列问题:
(1)装置B中发生反应的化学方程式是__________
(2)E中出现______________的现象。
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是__________
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的的原因:___________。
③将此滤液中FeCl2完全氧化为FeCl3最好选择_______做氧化剂。
【答案】3Fe+4H2O ![]() Fe3O4+4H2 黑色的粉末变成红色,管壁产生水珠 KSCN溶液 溶液变血红色 Fe+2Fe3+=3Fe2+ Cl2
Fe3O4+4H2 黑色的粉末变成红色,管壁产生水珠 KSCN溶液 溶液变血红色 Fe+2Fe3+=3Fe2+ Cl2
【解析】
本实验的目的是进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体;图中的装置,A是水蒸气发生器,B为Fe和水蒸气反应的装置,C是收集H2的装置,D为干燥装置,E为检验H2的装置;
(1)B中的反应是Fe和水蒸气的反应;
(2)E为检验H2的装置,则现象是黑色粉末变红,管壁有水珠生成;
(3)B中反应后的物质一定有Fe3O4,可能有多余的Fe,故用盐酸溶解B中反应后的产物,则溶液中一定有FeCl2,可能有FeCl3;
①检验Fe3+,需要使用KSCN溶液;
②若溶液中无Fe3+,是因为B中剩余的Fe消耗了Fe3+;
③想要得到纯净的FeCl3,最好使用Cl2氧化FeCl2,这样不会引入杂质。
(1)B装置为Fe和水蒸气反应的装置,发生的化学反应为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)E中H2还原CuO,对应的现象是黑色的粉末变成红色,管壁产生水珠;
(3)①B中反应后的产物有Fe3O4,将其用盐酸溶解后,用KSCN溶液检验Fe3+;加入KSCN溶液后,若溶液变为血红色,则说明溶解后的溶液有Fe3+;
②若没有检测到Fe3+,说明Fe3+被消耗了,根据题中所给的物质,只能是过量的Fe消耗了Fe3+,对应的离子方程式为:Fe+2Fe3+=3Fe2+;
③滤液中的FeCl2最好用Cl2氧化,这样不会引入其他杂质。