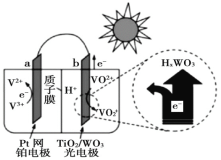
题目内容
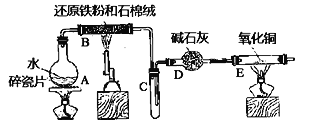
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有Na2SO4、NH3HCO3 等杂质 的NaCl。某学生设计了如下图方案提取纯净物的NaCl溶液(已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
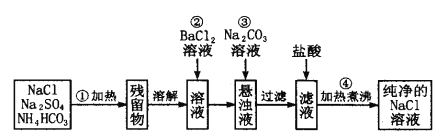
如果此方案正确,那么:
(1)操作①可选择_______ 或__________(仪器)。
(2)操作②为什么不用加硝酸钡溶液?其理由是___________。
(3)进行操作②后,如何判断SO42-已除尽的方法是__________ 。
(4)操作③的目的是________,写出此操作涉及的离子方程式:___________
(5)操作④的目的是_________。
【答案】蒸发皿 坩埚 改用Ba(NO3)2会使溶液中引入新的杂质离子NO3- 取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有(或其他的方法) 除去过量的Ba2+ Ba2++ CO32-= BaCO3 ↓ 除去溶解在溶液中的CO2和HCl
【解析】
根据题中的信息,将物质的除杂流程详细化:
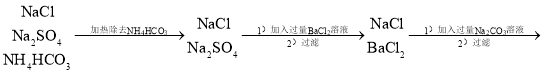
![]() ,其中加入过量BaCl2是为了除去Na2SO4,加入过量的Na2CO3溶液是为了除去BaCl2,加入过量的HCl是为了除去Na2CO3,多余的盐酸通过加热煮沸可以使HCl从水中逸出,同时还能使微溶于水的CO2也逸出,从而得到纯净的NaCl溶液。
,其中加入过量BaCl2是为了除去Na2SO4,加入过量的Na2CO3溶液是为了除去BaCl2,加入过量的HCl是为了除去Na2CO3,多余的盐酸通过加热煮沸可以使HCl从水中逸出,同时还能使微溶于水的CO2也逸出,从而得到纯净的NaCl溶液。
(1)加热固体,可以在坩埚中进行,也可以在蒸发皿中进行;
(2)操作②中,如果加入的是Ba(NO3)2溶液,则生成物里有NaNO3,即引入了新杂质离子NO3-;
(3)检验SO42-的操作为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有;
(4)操作③中,加入Na2CO3溶液是为了除去Ba2+,相关的离子方程式为:Ba2++CO32-=BaCO3 ↓;
(5)操作④的目的是除去溶解在溶液中的CO2和HCl。

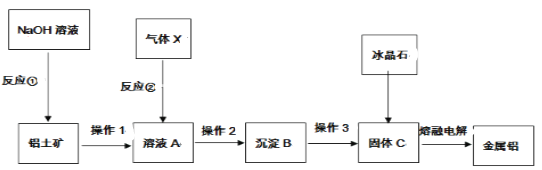
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、FeO、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图:
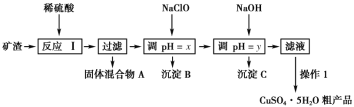
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是__(任写1条)。
(2)固体混合物A中的成分是__。
(3)反应Ⅰ完成后,铁元素的存在形式为__(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式__。
(4)操作1主要包括:__、__、__。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是__。
(5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为__,该反应中氧化剂与还原剂的物质的量之比为__。
(6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为__。