��Ŀ����
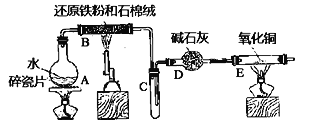
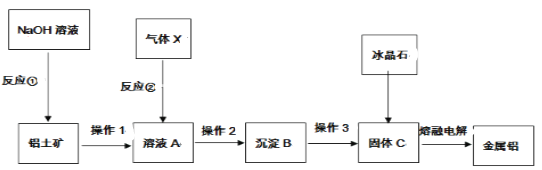
����Ŀ��һ�������ȶƹܷ���п����ZnSO4��7H2O���壬������ȡZnO����̽����缫��ѹ��ԭ����п��ⷨ��п�ķ���������������ͼ��ʾ��
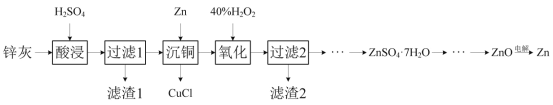
��֪����п�ҵ���Ҫ�ɷ�ΪZnO��ZnCl2��������SiO2��CuO��PbO��FeO��
��Cu++Cl-=CuCl��
�ش��������⣺
��1������1����Ҫ�ɷ�ΪSiO2��__��
��2�����ʱ��������Ũ�ȹ��ߣ����ܷ�������Ӧ�Ļ�ѧ����ʽΪ__��
��3��д������ͭ��ʱ�����ӷ���ʽ__��
��4����pHΪ5.6���������������ټ���۱�ϩ���������������Ƚ��裬��Ŀ����__��
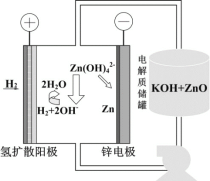
��5����缫��ѹ��ԭ����п��װ����ͼ��ʾ��������ZnO�ܽ���γ�Zn(OH)![]() ���ӣ�ÿ�ܽ�1molZnO������__molKOH�������е��ܷ�Ӧ���ӷ���ʽΪ��__��
���ӣ�ÿ�ܽ�1molZnO������__molKOH�������е��ܷ�Ӧ���ӷ���ʽΪ��__��
��6���ù��շ�ˮ�к���Zn2+���ŷ�ǰ�账�������ˮ�м���CH3COOH��CH3COONa��ɵĻ�����Һ����pH��ͨ��H2S������Ӧ��Zn2++H2S![]() ZnS(s)+2H+��������ķ�ˮ�в�������Ũ��Ϊ��
ZnS(s)+2H+��������ķ�ˮ�в�������Ũ��Ϊ��
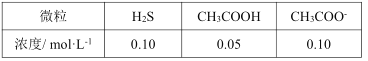
������ķ�ˮ��pH=__��c(Zn2+)=__��
����֪��Ksp(ZnS)=1.0��10-23��Ka1(H2S)=1.0��10-7��Ka2(H2S)=1.0��10-14��Ka(CH3COOH)=2.0��10-5��
���𰸡�PbSO4 2FeO+4H2SO4(Ũ)=Fe2(SO4)2+SO2��+4H2O Zn+2Cu2++2Cl-=2CuCl��+Zn2+ ��ʹFe(OH)3����۳��������ڹ��˷��� 2 H2+Zn(OH)42-![]() 2H2O+Zn+2OH- 5 1��10-11mol��L-1
2H2O+Zn+2OH- 5 1��10-11mol��L-1
��������
п��(��Ҫ�ɷ���ZnO��ZnCl2��������SiO2��CuO��PbO��FeO��)���������������PbOת����PbSO4������SiO2���������ˮ������˵õ�������1��ҪΪPbSO4��SiO2����Һ����ZnSO4��FeSO4��CuSO4��H2SO4������Һ�м���Zn�ۣ���Cu2+��ԭ��������CuCl�����ﵽ��ͭ��Ŀ�ģ���������Һ�м���˫��ˮ��Fe2+������Fe3+���ټ���ZnO������ҺpH����Fe3+ת���������������������˳�ȥ������Һ������Ũ������ȴ�ᾧ�����˵õ�ZnSO47H2O����Һ��������������Һ������������п�����ȷֽ���������п�����������Zn���Դ˽����⡣
(1)����֪������1����Ҫ�ɷ�ΪSiO2��PbSO4��
(2)Ũ������ǿ�����ԣ����ʱ����ʹ������Ũ�ȹ��ߣ����ܽ�ʱ������FeO����Fe3+��ͬʱ����SO2����Ⱦ������������Ӧ�Ļ�ѧ����ʽΪ2FeO+4H2SO4(Ũ)=Fe2(SO4)2+SO2��+4H2O��
(3)����ͭ��ʱ����Zn�ۣ���Cu2+��ԭ��������CuCl������������Ӧ�����ӷ���ʽΪZn+2Cu2++2Cl-=2CuCl��+Zn2+��
(4)��pHΪ5.6�����������������ɵ�Fe3+ˮ�����������������壬��������۱�ϩ���������������Ƚ��裬�ɴ�ʹFe(OH)3����۳��������ڹ��˷��룻
(5)������ZnO�ܽ���γ�Zn(OH)![]() ���ӣ����������ӷ�Ӧ2OH����ZnO��H2O��Zn(OH)
���ӣ����������ӷ�Ӧ2OH����ZnO��H2O��Zn(OH)![]() ����ÿ�ܽ�1molZnO��������2molKOH�����������ϵ�H2�ڼ���������ʧ������������H2O���缫��ӦΪH2-2e-+2OH-=2H2O��������Zn(OH)
����ÿ�ܽ�1molZnO��������2molKOH�����������ϵ�H2�ڼ���������ʧ������������H2O���缫��ӦΪH2-2e-+2OH-=2H2O��������Zn(OH)![]() ���ӵõ��ӻ�ԭ����Zn���缫��ӦʽΪZn(OH)
���ӵõ��ӻ�ԭ����Zn���缫��ӦʽΪZn(OH)![]() +2e-=Zn+4OH-��������е��ܷ�Ӧ���ӷ���ʽΪH2+Zn(OH)42-
+2e-=Zn+4OH-��������е��ܷ�Ӧ���ӷ���ʽΪH2+Zn(OH)42-![]() 2H2O+Zn+2OH-��
2H2O+Zn+2OH-��
(6)��֪Ka(CH3COOH)= =
=![]() =2.0��10-5����c(H+)=1��10-5mol/L����ʱ��ҺpH=5��Ka2(H2S)��Ka1(H2S)=
=2.0��10-5����c(H+)=1��10-5mol/L����ʱ��ҺpH=5��Ka2(H2S)��Ka1(H2S)=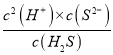 =1.0��10-7��1.0��10-14������c(H+)=1��10-5mol/L��c(H2S)=0.10mol/L����c(S2-)=1.0��10-12 mol/L����ʱKsp(ZnS)=1.0��10-23=c(Zn2+)��c(S2-)����c(Zn2+)=1��10-11mol��L-1��
=1.0��10-7��1.0��10-14������c(H+)=1��10-5mol/L��c(H2S)=0.10mol/L����c(S2-)=1.0��10-12 mol/L����ʱKsp(ZnS)=1.0��10-23=c(Zn2+)��c(S2-)����c(Zn2+)=1��10-11mol��L-1��

 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
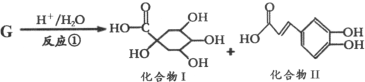
â���̸����������������ϵ�д�����Ŀ��ijͬѧ��ʵ���ҽ����������������ת��ʵ�顣
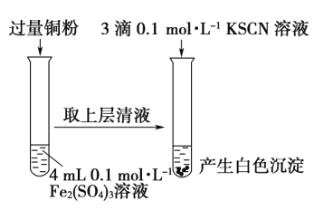
ʵ��������![]() ת��Ϊ
ת��Ϊ![]()
�������ϣ�
��֪����![]() �Ļ�ѧ������
�Ļ�ѧ������![]() ����
����
��![]()
ʵ��������![]() ת��Ϊ
ת��Ϊ![]()
ʵ�鷽�� | ���� |
�� | ��Һ��Ϊ��ɫ������һ��ʱ�����ɫ��ʧ����Һ��Ϊ��ɫ |
�������ϣ�![]() (��ɫ)
(��ɫ)
����˵������ȷ����
A.ȡ![]() ��Һ�������еμ�3��
��Һ�������еμ�3��![]() ��Һ��������ɫ����
��Һ��������ɫ����
B.ȡ![]() ��Һ�������еμ�3��
��Һ�������еμ�3��![]() ��Һ��������ɫ����
��Һ��������ɫ����
C.![]() ��
��![]() ��Ӧ�����ӷ���ʽΪ
��Ӧ�����ӷ���ʽΪ![]()
D.����![]() ��ԭ��
��ԭ��![]()