题目内容
7.下列关于16O与18O的说法正确的是( )| A. | 16O与18O互为同位素 | B. | 16O与18O具有不同的电子数 | ||
| C. | 16O与18O互为同素异形体 | D. | 16O与18O化学性质不同 |
分析 元素符号左上角的数字为质量数,左下角的数字为质子数,中子数=质量数-质子数,
A.质子数相同中子数不同的原子互称同位素;
B.原子核外电子数等于质子数;
C.同素异形体是同种元素形成的不同单质,同素异形体首先是单质,其次是同种元素;
D.元素的化学性质主要与元素的核外电子排布有关.
解答 解:元素符号左上角的数字为质量数,左下角的数字为质子数,中子数=质量数-质子数,
A.16O与18O质子数相同为8,中子数分别为8、10不同,故互为同位素,故A正确;
B.16O与18O的质子数都为8,核外电子数都为8,具有相同的电子数,故B错误;
C.16O与18O质子数相同,中子数不同的原子,同素异形体首先是单质,故C错误;
D.16O与18O 质子数都为8,核外电子数也都为8,核外电子排布相同,化学性质相似,故D错误;
故选A.
点评 本题考查原子符号的含义、同位素,同素异形体判别,准确把握质量数与质子数和中子数的关系、明晰同位素,同素异形体概念是解答关键,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
17.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,醋酸一定过量 | |
| C. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| D. | 在0.1mol•L-1NH4HSO4溶液中:c(H+)>c( SO42-)>c(NH4+)>c(OH-) |
18.原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-═Al3+ | |
| B. | Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-═Al3+ | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-═Cu2+ | |
| D. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-═Cu2+ |
15.糖类、脂肪和蛋白质是维持人体生命活动所必须的三大营养物质,下列叙述正确的是( )
| A. | 植物油是高分子化合物,不能使溴的四氯化碳溶液褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质溶液遇硫酸铜后发生的沉淀能重新溶于水 |
2.扑热息痛是一种优良的扑解热镇痛剂,其结构式为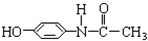 它可能具有的化学性质是( )
它可能具有的化学性质是( )
 它可能具有的化学性质是( )
它可能具有的化学性质是( )| A. | 不与烧碱溶液反应 | B. | 能与溴水发生加成反应 | ||
| C. | 不能被氧化 | D. | 遇FeCl3溶液呈现紫色 |
16.下列有关叙述正确的是( )
| A. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
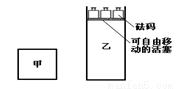
 C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。