题目内容
12.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);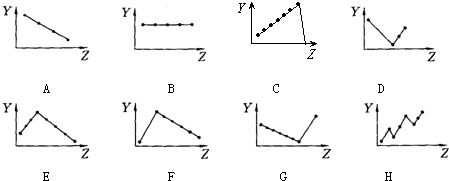
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数B (2)ⅦA族元素氢化物的沸点D
(3)第三周期元素单质的熔点E (4)第三周期元素的最高正化合价C
(5)IA族元素单质熔点F (6)F-、Na+、Mg2+、Al3+四种离子的离子半径A.
分析 (1)同一主族元素价电子数相等,与原子序数无关;
(2)ⅦA族元素氢化物的沸点随着原子序数增大而呈增大趋势,但HF沸点最高;
(3)第三周期元素单质的熔点随着原子序数增大先增大后减小;
(4)第三周期元素的最高正化合价随着原子序数增大而增大;
(5)IA族元素单质熔点随着原子序数增大而减小;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小.
解答 解:(1)同一主族元素价电子数相等,与原子序数无关,第IIA族元素价电子数都是2,故答案为:B;
(2)ⅦA族元素氢化物的晶体都是分子晶体,与其相对分子质量成正比,所以VIIA氢化物的沸点随着原子序数增大而呈增大趋势,但HF中含有氢键导致沸点最高,
故答案为:D;
(3)第三周期元素单质晶体类型依次为:金属晶体、原子晶体、分子晶体,所以其单质的熔点随着原子序数增大先增大后减小,原子晶体Si熔点最高,
故答案为:E;
(4)第三周期元素的最高正化合价随着原子序数增大而增大,故答案为:C;
(5)IA族元素单质中氢气是非金属单质,其余都是金属晶体,氢气单质的熔点最低,金属晶体的熔点与其原子半径成反比,所以碱金属族单质的熔点随着原子序数增大而减小,故答案为:F;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小,F-、Na+、Mg2+、Al3+四种离子的离子半径依次减小,故答案为:A.
点评 本题考查原子结构和元素性质,侧重考查元素周期律,熟练掌握同一周期、同一主族元素性质变化规律,并灵活运用这些规律解题,注意规律中的异常现象,注意(5)中第IA族元素要考虑H元素,为易错点.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
2.分子式为CH2Cl2的有机物同分异构体共有(不考虑立体异构)( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
3.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3.关于该物质的说法正确的是( )
| A. | 该物质属于两性氢氧化物 | |
| B. | 该药剂不适合于胃溃疡患者服用 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗3molH+ | |
| D. | 该物质是Al(OH)3和Na2CO3的混合物 |
7.下列关于16O与18O的说法正确的是( )
| A. | 16O与18O互为同位素 | B. | 16O与18O具有不同的电子数 | ||
| C. | 16O与18O互为同素异形体 | D. | 16O与18O化学性质不同 |
4.油脂的皂化反应是指油脂的( )
| A. | 氢化反应 | B. | 碱性水解反应 | C. | 加成反应 | D. | 氧化反应 |
1.已知16S和52Te位于同一主族,下列关系正确的是( )
| A. | 原子半径:Te>Cl>S | B. | 热稳定性:H2Te>H2S>PH3 | ||
| C. | 还原性:Cl->S2->Te2- | D. | 酸性:HClO4>H2SO4>H2TeO4 |
 O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2