题目内容
标准状况下分别向甲、乙、丙三个容器中加入30.0 mL同浓度的盐酸,再加入不同质量的由两种金属组成的同种合金粉末,测量放出气体的体积。另在甲、乙、丙三个容器中加入30.0 mL与盐酸同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积。所得数据如下表所示:
根据表中数据不可能得出的结论是
A.盐酸的物质的量浓度为2 mol·L-1 B.合金可能由镁与铝组成
C.x=2.016 D.y=2.016
| 反应容器 | 甲 | 乙 | 丙 |
| 合金的质量/g | 0.510 | 1.53 | 3.57 |
| 与盐酸反应产生气体的体积/L | 0.560 | 0.672 | 0.672 |
| 与氢氧化钠反应产生气体的体积/L | 0.336 | x | y |
A.盐酸的物质的量浓度为2 mol·L-1 B.合金可能由镁与铝组成
C.x=2.016 D.y=2.016
C
A:乙、两容器中的盐酸与合金反应产生的氢气的体积相同,可知,丙内的盐酸一定不足,由2HCl~H2↑可知盐酸中溶质为 0.06mol,盐酸的浓度为2 mol·L-1,正确
0.06mol,盐酸的浓度为2 mol·L-1,正确
B:甲容器中合金与盐酸反应,合金必定不足,假设合金由镁铝组成,其物质的量分别为x、y,则24x+27y=0.51 22.4×(x+3x/2)=0.56,可得x=y=0.01mol;而与NaOH反应中,只有铝可产生氢气,得到的氢气为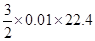 =0.336L,正确
=0.336L,正确
C:乙所对应合金中镁铝的物质的量均为0.03mol,与NaOH溶液反应时,铝粉不足,产生的氢气为: =1.008L,不正确
=1.008L,不正确
D:丙所对应合金中镁铝的物质的量均为0.07mol,与NaOH溶液反应时,铝粉过量,产生的氢气为: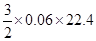 =2.016L,正确
=2.016L,正确
故C选项符合题意
 0.06mol,盐酸的浓度为2 mol·L-1,正确
0.06mol,盐酸的浓度为2 mol·L-1,正确B:甲容器中合金与盐酸反应,合金必定不足,假设合金由镁铝组成,其物质的量分别为x、y,则24x+27y=0.51 22.4×(x+3x/2)=0.56,可得x=y=0.01mol;而与NaOH反应中,只有铝可产生氢气,得到的氢气为
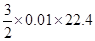 =0.336L,正确
=0.336L,正确C:乙所对应合金中镁铝的物质的量均为0.03mol,与NaOH溶液反应时,铝粉不足,产生的氢气为:
 =1.008L,不正确
=1.008L,不正确D:丙所对应合金中镁铝的物质的量均为0.07mol,与NaOH溶液反应时,铝粉过量,产生的氢气为:
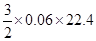 =2.016L,正确
=2.016L,正确故C选项符合题意

练习册系列答案
相关题目
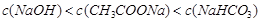
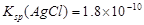 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到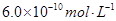
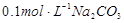 溶液中水电离出来的c(OH-)大于
溶液中水电离出来的c(OH-)大于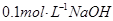 溶液中,水电离出来的c(OH-)
溶液中,水电离出来的c(OH-) 溶液的pH=4,则
溶液的pH=4,则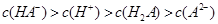
 _____________;
_____________; 耗c molBaCl2,沉淀反应刚好完全,
耗c molBaCl2,沉淀反应刚好完全, 原溶液中硝酸根离子的物质的量浓度为
原溶液中硝酸根离子的物质的量浓度为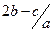 mol.l-1
mol.l-1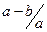 mol.l-1
mol.l-1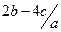 mol.l-1
mol.l-1 的值(写出计算过程)
的值(写出计算过程)