题目内容
下列溶液中有关物质的量浓度关系或计算正确的是
A.pH相等的NaOH、CH3COONa和NaHC03三种溶液,则有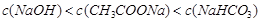 |
B.已知25℃时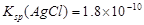 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到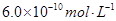 |
C.25℃时,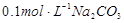 溶液中水电离出来的c(OH-)大于 溶液中水电离出来的c(OH-)大于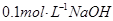 溶液中,水电离出来的c(OH-) 溶液中,水电离出来的c(OH-) |
D.室温下, 溶液的pH=4,则 溶液的pH=4,则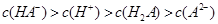 |
BC
A:由于醋酸的酸性大于碳酸,故等浓度的NaOH、CH3COONa和NaHC03三种溶液,pH由大到小的顺序为:NaOH、NaHC03、CH3COONa,反之,若三溶液的pH相等,则三者的浓度由大到小的顺序为CH3COONa、NaHC03、NaOH
B:在0.1mol·L-1AlCl3溶液中,c(Cl—)=0.3mol·L-1,则Ag+的物质的量浓度最大可达到 =mol·L-1
=mol·L-1
C:前者水解促进水的电离,而后者抑制水的电离,正确
D:溶液中存在平衡:HA- H++A2- HA-+H2O
H++A2- HA-+H2O H2A+OH- H2O
H2A+OH- H2O H++OH-,由于溶液呈酸性,电离程度大于水解:c(HA-)>c(H+)>c(A2-)>c(H2A)
H++OH-,由于溶液呈酸性,电离程度大于水解:c(HA-)>c(H+)>c(A2-)>c(H2A)
答案为BC
B:在0.1mol·L-1AlCl3溶液中,c(Cl—)=0.3mol·L-1,则Ag+的物质的量浓度最大可达到
 =mol·L-1
=mol·L-1C:前者水解促进水的电离,而后者抑制水的电离,正确
D:溶液中存在平衡:HA-
 H++A2- HA-+H2O
H++A2- HA-+H2O H2A+OH- H2O
H2A+OH- H2O H++OH-,由于溶液呈酸性,电离程度大于水解:c(HA-)>c(H+)>c(A2-)>c(H2A)
H++OH-,由于溶液呈酸性,电离程度大于水解:c(HA-)>c(H+)>c(A2-)>c(H2A)答案为BC

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目

