题目内容
把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入b mol 烧碱并加热,刚好把NH3全部赶出。另一份需消 耗c molBaCl2,沉淀反应刚好完全,
耗c molBaCl2,沉淀反应刚好完全, 原溶液中硝酸根离子的物质的量浓度为
原溶液中硝酸根离子的物质的量浓度为
 耗c molBaCl2,沉淀反应刚好完全,
耗c molBaCl2,沉淀反应刚好完全, 原溶液中硝酸根离子的物质的量浓度为
原溶液中硝酸根离子的物质的量浓度为A.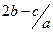 mol.l-1 mol.l-1 | B.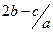 mol.l-1 mol.l-1 |
C.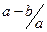 mol.l-1 mol.l-1 | D.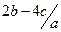 mol.l-1 mol.l-1 |
D
略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 子数之比是 。
子数之比是 。