题目内容
【题目】(1)铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。

已知:i. Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g);△H1=+19.3 kJ·mol-1
3FeO(s)+CO2(g);△H1=+19.3 kJ·mol-1
ii. 3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g);△H2=-57.2 kJ·mol-1
Fe3O4(s)+H2(g);△H2=-57.2 kJ·mol-1
iii. C(s)+CO2(g)![]() 2CO(g);△H3=+172.4 k]·mol-1
2CO(g);△H3=+172.4 k]·mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是___________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和炭粉,发生反应Fe2O3(s)+3C(s)![]() 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是___________(填写字母)。
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是___________(填写字母)。

a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应,平衡时体系中气体体积分数与温度的关系如图所示
①650℃时,该反应达平衡后吸收的热量是___________。
②T℃时,若向平衡体系中再充入一定量按V(CO2)︰V(CO)=5︰4的混合气体,平衡___________(填“正向”、“逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为___________。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]

(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如下图所示(导电壳内部为纳米零价铁)

在除污过程中,纳米零价铁中的Fe为原电池的___________极(填“正”或“负”),写出C2HCl3在其表面转化为乙烷的电极反应式为___________。
(5)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制100mL5mol·L-1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2mol·L-1的盐酸_________mL(忽略加入盐酸体积)。
【答案】C(s)+H2O(g)![]() H2(g)+CO(g)ΔH=+134.5 kJ·mol-1 ad 43kJ 正向 23.04P总 负 C2HCl3 +5H++8e-=C2H6 +3C1- 2.5
H2(g)+CO(g)ΔH=+134.5 kJ·mol-1 ad 43kJ 正向 23.04P总 负 C2HCl3 +5H++8e-=C2H6 +3C1- 2.5
【解析】
(1)根据盖斯定律对热化学方程式运算。
(2)由图像可知,t1时改变条件使逆反应速率突然增大,达到新平衡时反应速率跟原速率相等,根据这一特点并结合平衡常数只与温度有关等知识分析。
(3)密闭容器中建立的平衡为C(s)+CO2(g)![]() 2CO(g)。①运用“三段式”分析计算参加反应的CO2的物质的量,再结合热化学方程式的意义计算吸收的热量;②根据V(CO2)︰V(CO)=5︰4>1:1分析解答;③根据平衡常数表达式并结合气体分压定义分析。
2CO(g)。①运用“三段式”分析计算参加反应的CO2的物质的量,再结合热化学方程式的意义计算吸收的热量;②根据V(CO2)︰V(CO)=5︰4>1:1分析解答;③根据平衡常数表达式并结合气体分压定义分析。
(4)由图可知纳米零价铁中Fe失去电子,根据原电池原理分析。
(5)配制过程中出现浑浊现象是因为生成了难溶于水的Fe(OH)3,根据溶解平衡知识只要c(Fe3+)·c3(OH-)< Ksp[Fe(OH)3],就不会有沉淀生成,据此分析计算。
(1)根据盖斯定律,将i+ii+iii得:C(s)+H2O(g)![]() H2(g)+CO(g);ΔH=+134.5 kJ·mol-1。
H2(g)+CO(g);ΔH=+134.5 kJ·mol-1。
(2)密闭容器中建立的平衡为Fe2O3(s)+3C(s)![]() 2Fe(s)+3CO(g),由图像可知,t1时改变条件使逆反应速率突然增大,达到新平衡时反应速率跟原速率相等。a.t1时保持温度不变,压缩容器使气体压强增大,逆反应速率突然增大,由于温度不变,所以平衡常数K=c3(CO)不变,所以达到新平衡时c(CO)不变,逆反应速率不变,符合图像,a项正确;b.t1时保持体积不变,升高温度使逆反应速率突然增大,但达到新平衡时温度比原来高,所以达到新平衡时逆反应速率比原来大,不符合图像,b项错误;c.t1时保持体积不变,加少量碳粉,固体物质的浓度视为常数,所以t1时逆反应速率不会发生突变,不符图像,c项错误;d.t1时保持体积不变,增大CO浓度,使逆反应速率突然增大,因温度不变,达到新平衡时平衡常数K=c3(CO)不变,即c(CO)浓度不变,所以达到新平衡时逆反应速率不变,符合图像,d项正确;答案选ad。
2Fe(s)+3CO(g),由图像可知,t1时改变条件使逆反应速率突然增大,达到新平衡时反应速率跟原速率相等。a.t1时保持温度不变,压缩容器使气体压强增大,逆反应速率突然增大,由于温度不变,所以平衡常数K=c3(CO)不变,所以达到新平衡时c(CO)不变,逆反应速率不变,符合图像,a项正确;b.t1时保持体积不变,升高温度使逆反应速率突然增大,但达到新平衡时温度比原来高,所以达到新平衡时逆反应速率比原来大,不符合图像,b项错误;c.t1时保持体积不变,加少量碳粉,固体物质的浓度视为常数,所以t1时逆反应速率不会发生突变,不符图像,c项错误;d.t1时保持体积不变,增大CO浓度,使逆反应速率突然增大,因温度不变,达到新平衡时平衡常数K=c3(CO)不变,即c(CO)浓度不变,所以达到新平衡时逆反应速率不变,符合图像,d项正确;答案选ad。
(3) ①由图像可知,6500C时反应达到平衡后CO的体积分数为40%,设达到平衡时转化的CO2的物质的量为x。应用“三段式”分析得:
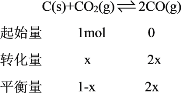
CO的体积分数=![]() ×100%=40%,解得x=0.25mol,由C(s)+CO2(g)
×100%=40%,解得x=0.25mol,由C(s)+CO2(g)![]() 2CO(g); △H3=+172.4 k]·mol-1可知,该反应达到平衡后吸收的热量是:0.25mol×172kJ/mol=43kJ。
2CO(g); △H3=+172.4 k]·mol-1可知,该反应达到平衡后吸收的热量是:0.25mol×172kJ/mol=43kJ。
②由图像知T0C时CO2和CO的体积分数相等,即V(CO2):V(CO)=1:1,T℃时,向平衡体系中再充入一定量按V(CO2):V(CO)=5:4的混合气体,因V(CO2):V(CO)=5:4>1:1,(相当于增大CO2浓度)所以平衡向正反应方向移动。
③925℃时,CO的体积分数为96%,则CO2的体积分数为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=![]() =23.04P总。
=23.04P总。
(4)由图可知纳米零价铁中Fe失去电子转化为Fe2+,由原电池原理知,纳米零价铁中的Fe作原电池的负极。因根据碳元素化合价知,C2HCl3在其表面被还原为乙烷,根据电荷守恒和原子守恒,该电极反应式为:C2HCl3 +5H++8e-=C2H6 +3C1-。
(5)Fe(OH)3难溶于水,在溶液中存在溶解平衡:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq)。为使配制过程中不出现浑浊现象,则c(Fe3+)·c3(OH-)< Ksp[Fe(OH)3],即c(OH-)<
Fe3+(aq)+3OH-(aq)。为使配制过程中不出现浑浊现象,则c(Fe3+)·c3(OH-)< Ksp[Fe(OH)3],即c(OH-)<![]()
![]() =2×10-13mol/L,则c(H+)=
=2×10-13mol/L,则c(H+)=![]() >
>![]() =0.05mol/L。设加入盐酸体积为x(忽略溶液体积的变化),加入盐酸后溶液中c(H+)=
=0.05mol/L。设加入盐酸体积为x(忽略溶液体积的变化),加入盐酸后溶液中c(H+)=![]() =0.05mol/L,解得x=0.0025L(2.5mL),即至少需要加入2.5mL盐酸。
=0.05mol/L,解得x=0.0025L(2.5mL),即至少需要加入2.5mL盐酸。

【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案,其中t3 <t2 <t1:
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | |||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 | t1 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 | t2 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | t3 |
请回答:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。当观察到紫色刚好褪去,参加反应的H2C2O4和KMnO4的物质的量之比为n(H2C2O4)∶n(KMnO4)=_________。
(2)实验①测得KMnO4溶液的褪色时间为t1=40s,忽略混合前后溶液体积的变化,这段时间内平均反应速率υ(KMnO4)=___________mol/(L·min)。
(3)根据表中的实验②和实验③数据,可以得到的结论是__________________________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图a所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应当如图b所示:

该小组同学根据图b所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是__________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 向试管中加入少量固体 | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
④ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | _____ | t4 |
③若该小组同学提出的假设成立,应观察到的现象是___________________________。




