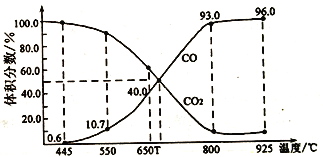
题目内容
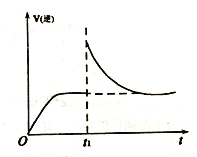
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
【答案】A
【解析】
试题A、平衡常数只受温度影响,温度不变平衡常数不变,与物质的浓度无关,增大NO的物质的量,不影响平衡常数,故A正确;
B、该反应正反应为放热反应,升高温度平衡向逆反应移动,CO的转化率降低,故B错误;
C、平衡常数只受温度影响,升高温度平衡向吸热反应移动,该反应正反应为放热反应,故升高温度平衡向逆反应移动,平衡常数降低,故C错误;
D、增大氮气的物质的量,氮气的浓度增大,平衡向逆反应移动,NO的转化率降低,故D错误。
故选:A。

【题目】联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:
X | |||||||||||||||||
(1)碳元素在周期表中的位置是______。
(2)将硅的元素符号填写在上述周期表相应的空格中_______。
(3)在上述周期表中,用实线画出周期表的上方边界________。
(4)从原子结构角度解释碳化硅中碳元素显负价的原因______。
(5)第118号元素为Og(中文名“![]() ”,ào),下列说法不正确的是______。
”,ào),下列说法不正确的是______。
a.Og是第七周期0族元素 b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强 d.中子数为179的Og核素符号是![]()
(6)已知X与Y是位于相邻周期的同主族元素。某温度下,X、Y的单质与H2化合生成气态氢化物的平衡常数分别为KX =9.7×1012、KY =5.6×107。Y是______(填元素符号),判断理由是______。
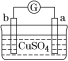
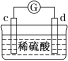
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c