��Ŀ����
����Ŀ����֪��Ӧ��2S02(g)+02(g) ![]() 2S03(g) ��H <0����ش��������⣺
2S03(g) ��H <0����ش��������⣺
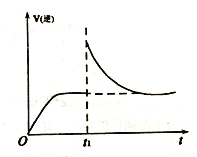
��1��ij�¶��£���һ�̶�������ܱ������м���100g SO3(g)����������Ӧ��������˵���÷�Ӧ�Ѵﵽƽ��״̬����_____(����ţ�
��ÿ����80g S03��ͬʱ����64gSO2
�ڻ��������ܶȱ��ֲ���
��SO3������������ֲ���
�ܻ�������ƽ����Է����������ٱ仯
��2��ij�¶��£���һ�̶����Ϊ2�����ܱ������У�����2molS02��lmol02����������Ӧ������Ӧ���е�2����ĩʱ�ﵽƽ�⣬ƽ��������S03����������Ϊ50%����Ӧǰ2��������S02��ʾ��ƽ����Ӧ����Ϊ_____��S02��ת����Ϊ____����ʱ��Ӧ��ƽ�ⳣ��Ϊ_________��
��3����ij���¡���ѹ�����У��������2: 1����S02��02����������Ӧ���ﵽƽ������������г�������S03(g)���ﵽ��ƽ��ʱ��c(02)����ԭƽ��_____(���������С�������䡱)
��4������ij���¡����������У�����һ����S03(g)����������Ӧ���ﵽƽ����������� �г�������S03(g)���ﵽ��ƽ��ʱ��c(S02)/c(S03)����ԭƽ��______(���������С�������䡱)��
���𰸡��ۢ�0.25molL-1min-150%4�����С
��������
��1����ÿ����80gS03����Ӧ���ҽ��У�ͬʱ����64gSO2����Ӧ���ҽ��У�����ͬ�����жϷ�Ӧ�ﵽƽ��״̬���ʲ�ѡ��
�ڸ�����������䡢��Ӧǰ����������������,���������ܶ�ʼ�ղ���,���ܸ����ܶ��ж�ƽ��״̬,�ʲ�ѡ��
��SO3������������ֲ��䣬������Ũ�ȱ��ֲ��䣬��Ӧ�ﵽƽ��״̬����ѡ��
�ܸ÷�Ӧ����������ֽ����������ʵ������������������������,���������ƽ����Է��������ڷ�Ӧǰ���С,�������л�������ƽ����Է����������ֲ���ʱ,���淴Ӧ�������,�÷�Ӧ�ﵽƽ��״̬,��ѡ��
��������������ѡ�ۢܡ�
��2����һ�̶����Ϊ2�����ܱ������У�����2molS02��lmol02����2SO2+O2==2SO3��Ӧ���赱��Ӧ���е�2����ĩʱ�ﵽƽ��ʱ��������������Ϊxmol���������¼��㣺
2SO2 + O2 ![]() 2SO3��
2SO3��
��ʼ�� 2 1 0
�仯�� 2x x 2x
ƽ���� 2-2x 1-x 2x
����ƽ��������S03����������Ϊ50%����50%=2x��80/(2��64+1��32)��100%�����x=0.5mol����Ӧǰ2��������S02��ʾ��ƽ����Ӧ����Ϊ2��0.5/(2��2)=0.25molL-1min-1��S02��ת����Ϊ2��0.5/2��100%=50%����ƽ��ʱ������Ũ�ȷֱ�Ϊ��c(SO2)=��2-1��/2=0.5mol/L��c(O2)=��1-0.5��/2=0.25mol/L��c(SO3)=2��0.5/2=0.5mol/L����ʱ��Ӧ��ƽ�ⳣ��Ϊ0.52/(0.25��0.52)=4���������������������0.25molL-1min��50%��4��
��3�����ֺ��¡���ѹ����Ӧ�ﵽƽ������������г�������S03(g)���ں�ѹ�����£���ԭƽ��״̬��ͬ���ǵ�Чƽ�⣬�����ʵĺ������䣬����c(02)��ԭƽ����ȣ�Ӧ��Ϊ���䣻�������������������������
��4�����¡����������·�Ӧ�ﵽƽ�⣬�ﵽƽ������������г�������S03(g)�����������������ԭƽ�⣬��Ч�ڼ�ѹ���̣�ƽ�������ƶ���c(S03)����c(S02)��С��c(S02)/c(S03)����ԭƽ���С������������������ǣ���С��

 ������������Ծ�ϵ�д�
������������Ծ�ϵ�д� �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д�����Ŀ�����Ϲ���2019�궨Ϊ�����ʻ�ѧԪ�����ڱ�������2018���й���ѧ���������°����ڱ�������118��Ԫ�ء��ش��������⣺
X | |||||||||||||||||
(1)̼Ԫ�������ڱ��е�λ����______��
(2)�����Ԫ�ط�����д���������ڱ���Ӧ�Ŀո���_______��
(3)���������ڱ��У���ʵ�������ڱ����Ϸ��߽�________��
(4)��ԭ�ӽṹ�ǶȽ���̼������̼Ԫ���Ը��۵�ԭ��______��
(5)��118��Ԫ��ΪOg(��������![]() ������o)������˵������ȷ����______��
������o)������˵������ȷ����______��
a��Og�ǵ�������0��Ԫ�� b��Ogԭ�ӵĺ�����118������
c��Og��ͬ����Ԫ���зǽ�������ǿ d��������Ϊ179��Og���ط�����![]()
(6)��֪X��Y��λ���������ڵ�ͬ����Ԫ�ء�ij�¶��£�X��Y�ĵ�����H2����������̬�⻯���ƽ�ⳣ���ֱ�ΪKX =9.7��1012��KY =5.6��107��Y��______(��Ԫ�ط���)���ж�������______��