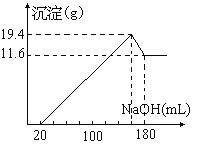
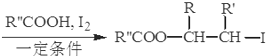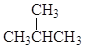题目内容
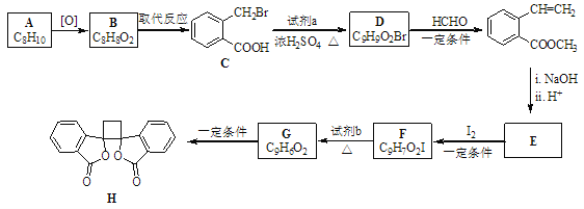
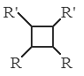
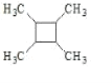
【题目】B的产量可以用来衡量一个国家的石油化工发展水平。A、B、C、D、E之间能进行如图所示的反应。
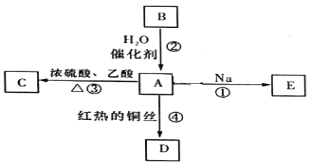
(1)A的官能团的名称________________,B的电子式为________________。
(2)写出①发生的化学反应方程式______________________。
(3)写出反应④的化学反应方程式______________________。
(4)下列关于化合物B的说法正确的是_____________(填字母)。
A.B分子中所有原子都在同一平面上
B.相同物质的量的B和甲烷完全燃烧消耗氧气的量相同
C.B可以与Cl2发生加成反应
D.B使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理相同
【答案】羟基 ![]() 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 2CH2CH2OH+O2
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 2CH2CH2OH+O2![]() 2CH3CHO+2H2O AC
2CH3CHO+2H2O AC
【解析】
B的产量可以用来衡量一个国家的石油化工发展水平,故B是乙烯(CH2=CH2)。乙烯与水发生加成反应得到A:CH2 = CH2+ H2O![]() CH3CH2OH,故A是乙醇(CH3CH2OH),乙醇与钠反应得到E:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,故E是乙醇钠(CH3CH2ONa),乙醇与乙酸在浓硫酸的催化下反应得到C:CH3COOH+CH3CH2OH
CH3CH2OH,故A是乙醇(CH3CH2OH),乙醇与钠反应得到E:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,故E是乙醇钠(CH3CH2ONa),乙醇与乙酸在浓硫酸的催化下反应得到C:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故C是乙酸乙酯(CH3COOCH2CH3),乙醇在Cu催化下与氧气发生催化氧化得到D:2CH2CH2OH+O2
CH3COOCH2CH3+H2O,故C是乙酸乙酯(CH3COOCH2CH3),乙醇在Cu催化下与氧气发生催化氧化得到D:2CH2CH2OH+O2![]() 2CH3CHO+2H2O,故D是乙醛(CH3CHO)。
2CH3CHO+2H2O,故D是乙醛(CH3CHO)。
(1)根据分析,A是乙醇(CH3CH2OH),官能团是羟基;B是乙烯,乙烯是共价化合物,碳和氢之间共用1对电子,碳和碳之间共用2对电子,电子式为![]() ;
;
(2)根据分析,①是乙醇与Na的反应,化学反应方程式为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(3)根据分析,④是乙醇的催化氧化反应,化学反应方程式为:2CH2CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(4)A.乙烯分子中的六个原子均在同一平面,A正确;
B.1mol乙烯完全燃烧消耗3molO2,1mol甲烷完全燃烧消耗2molO2,等物质的量的二者消耗O2的量不同,B错误;
C.乙烯有碳碳双键,可以与Cl2发生加成反应,C正确;
D.乙烯使溴的四氯化碳溶液褪色发生的是加成反应,使酸性高锰酸钾溶液褪色发生的是氧化反应,原理不同,D错误;
故选AC。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
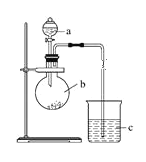
I.制备过程: 装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
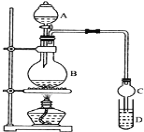
(1)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是________(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(2)球形干燥管的主要作用是_________________________。
(3)饱和Na2CO3溶液的作用是_______________________________________________________
II.提纯方法:①将D中混合液进行分离。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(4)第①步分离混合液时,选用的主要玻璃仪器的名称是_________________。
(5)第②步中用饱和食盐水洗去碳酸钠后、再用饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的__________________,______________。